
| A. | NaOH | B. | Na2CO3 | C. | NaI | D. | NaBr |
分析 根据氯气能与碱反应来吸收氯气以防止氯气中毒,注意碱性太强时,其腐蚀性强,反应生成的物质有毒性和刺激性也不符合,以此来解答.
解答 解:A、浓NaOH虽能与氯气反应,达到吸收氯气的效果,但浓NaOH的腐蚀性强,不能用浸有浓NaOH溶液的毛巾捂住鼻子,故A错误;
B、Na2CO3溶液显碱性,能与氯气反应而防止吸入氯气中毒,则可以用浸有Na2CO3溶液的毛巾捂住鼻子,故B正确;
C、NaI与氯气反应生成碘单质,碘蒸汽强烈刺激眼睛、皮肤和呼吸器官,不能用浸有NaI溶液的毛巾捂住鼻子来防止吸入氯气中毒,故C错误;
D、NaBr和氯气反应生成溴单质,溴单质也是刺激性的有毒气体,不能用来吸收氯气,故D错误.
故选B.
点评 本题考查氯气的化学性质及防止氯气中毒,明确氯气与碱反应及物质的腐蚀性是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:填空题
 目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1
目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
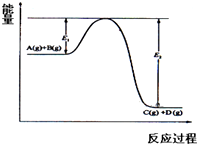 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
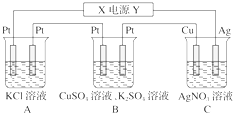 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1 mol•L-1的Al2(SO4)3溶液中,Al3+的数目为0.2 NA | |
| B. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1 NA | |
| C. | 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为 0.1NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
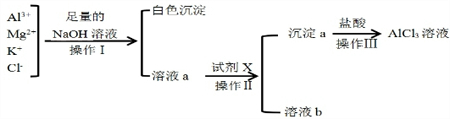 某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com