
A、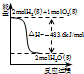 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ?mol-1 | B、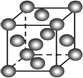 表示Cu形成金属晶体时的堆积方式 | C、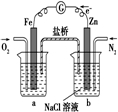 烧杯a中的溶液pH降低 | D、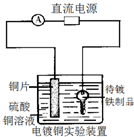 待镀铁制品应与电源正极相连 |


科目:高中化学 来源: 题型:
| 化学方程式 | 平衡常数K |
| F2+H22HF | 6.5×1095 |
| Cl2+H22HCl | 2.6×1033 |
| Br2+H22HBr | 1.9×1019 |
| I2+H22HI | 8.7×102 |
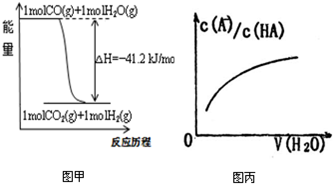
| A、已知CO的燃烧热283kJ/mol,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
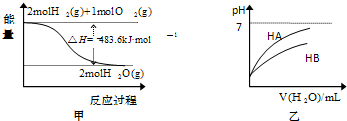
| A、甲表示1mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量 | B、甲表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ | C、乙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温同浓度的NaA溶液的pH小于NaB溶液的pH | D、乙图中起始时HA的物质的量浓度大于HB |
查看答案和解析>>
科目:高中化学 来源: 题型:
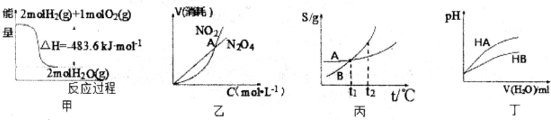
| A、丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | B、丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH | C、甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-241.8kJ?mol-1 | D、乙表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com