
电解原理在工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
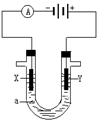
(1)若X、Y是惰性电极,a是200mLNaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为_____,在X极附近观察到的现象是 :_______。Y电极上的电极反应式是_________,检验该电极反应产物的方法是 :________________。当外电路通过0.02 mol电子时,充分混合电解后的溶液,忽略溶液体积变化,理论上溶液的PH值为_______。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,Y电极的材料是______,Y电极反应式是_______________。
(每空1分,共8分)(1)2H++2e-=H2↑ 有气泡,溶液变红 2Cl-—2e-==Cl2↑
把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2 13
(2)纯铜 粗铜 Cu-2e-==Cu2+
【解析】
试题分析:(1)根据装置图可知,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑。由于氢离子放电,破坏了阴极周围水的电离平衡,则阴极周围溶液显碱性,即在X极附近观察到的现象是有气泡,溶液变红;和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl-—2e-==Cl2↑。氯气具有强氧化性,据此可以鉴别,即把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2 。当外电路通过0.02 mol电子时有0.02mol氢离子放电,则生成OH-的物质的量就是0.02mol,所以溶液中中OH-的浓度是0.02mol÷0.2L=0.1mol/L,则pH=13。
(2)电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu;电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+。
考点:考查电解池的工作原理的有关判断和原因
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,基础性强。该题需要注意的是明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,有利于培养学生的逻辑推理能力和规范答题能力,提高学生灵活运用基础知识解决实际问题的能力。


科目:高中化学 来源: 题型:阅读理解

| (15-cVb) |
| Va |
| (15-cVb) |
| Va |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com