
VL Fe2(S O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
A.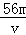 mol/L B.
mol/L B.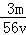 mol/L C.
mol/L C.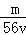 mol/L D.
mol/L D. mol/L
mol/L
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
在标准状况下,由0.5gH2、11g CO2和4g O2组成的混合气体,其体积约为
A.8.4L  B.11.2L C.14.0L D.16.8L
B.11.2L C.14.0L D.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
将5mol/L盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度为
A.0.05mol/L B.0.25mol/L C.0.1mol/L D.0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量0.40g NaOH固体,在烧杯中加入100mL 水溶解即可 | |
| B. | 将称量好的固体NaOH放入100 mL容量瓶中,加蒸馏水溶解至环形刻线 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液冷却到室温后,转移至容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
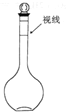 欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )| A. | ②④ | B. | ②③ | C. | ①③ | D. | 以上都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
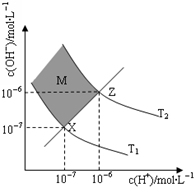 醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com