
 可逆反应在一定条件下达到平衡后,速率差值[即v(正)-v(逆)]与压强的变化曲线如图所示,其中与曲线①相符的反应为( )
可逆反应在一定条件下达到平衡后,速率差值[即v(正)-v(逆)]与压强的变化曲线如图所示,其中与曲线①相符的反应为( )| A、2SO3(g)?2SO2(g)+02(g) |
| B、H2(g)+I2(g)?2HI(g) |
| C、C(s)+H2O(g)?C0(g)+H2(g) |
| D、N2(g)+3H2(g)?2NH3(g) |


科目:高中化学 来源: 题型:
| A、8.9×10-3mol |
| B、4.5×10-2mol |
| C、1.1×102mol |
| D、5.6×10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
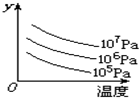 图中表示外界条件(t、p)的变化对下列反应的影响:L(s)+G(g)?2R(g)正反应是吸热反应),y 轴表示的是( )
图中表示外界条件(t、p)的变化对下列反应的影响:L(s)+G(g)?2R(g)正反应是吸热反应),y 轴表示的是( )| A、平衡时,混合气中R的百分含量 |
| B、G的转化率 |
| C、平衡时,混合气中G的百分含量 |
| D、L的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推广利用CO2与环氧丙烷和琥珀酸酐的三元共聚物的生物降解材料 |
| B、使用填埋法处理未经分类的生活垃圾 |
| C、推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料 |
| D、发展水电,开发新能源,如核能、太阳能、风能等,减少对化石能源的依赖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.7 L |
| B、1.4 L |
| C、1.6 L |
| D、2.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
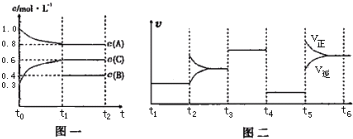
| A、此温度下该反应的化学方程式2A(g)+B(g)?2C(g) | ||||
| B、t4~t5阶段改变的条件为减小压强 | ||||
| C、B 的起始物质的量为1.0mol | ||||
D、在相同条件下,若起始时容器中加入amol A、bmol B 和cmol C,要达到 t1时刻同样的平衡,a、b、c 要满足的条件为a+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| B、为增强高锰酸钾溶液的氧化性,可用盐酸将高锰酸钾溶液酸化 |
| C、将苯与溴水混合后,再加铁粉,即可制得溴苯 |
| D、在测定盐酸和氢氧化钠溶液反应的中和热时,氢氧化钠溶液应过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、流程①中除去粗盐中的SO42-,Ca2+,Mg2+,Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B、流程②中结晶出的MgCl2?6H2O可在空气中受热分解制无水MgCl2 |
| C、在流程③④⑤中溴元素均被氧化 |
| D、大量的氮、磷废水排入海洋,易引发赤潮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com