
【题目】配制500 mL0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为____________。(精确到0.1g)
(2)有以下仪器:①烧杯 ②100ml量筒 ③1000ml容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管
(Ⅰ)配制时,必须使用的仪器有_____(填代号),还缺少的仪器是__;
(Ⅱ)实验两次用到玻璃棒,其作用分别是:______________、_____________。
(Ⅲ)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_______________
(3)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是_______。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水定容时俯视刻度线
【答案】 10.0g ①④⑤⑥ 胶头滴管 搅拌 引流 ②①③⑧⑤⑥⑦④ AC
【解析】试题分析:(1)根据m=cvM计算需要NaOH固体的质量;(2)(Ⅰ)根据实验步骤分析使用的仪器; (Ⅱ)实验中溶解氢氧化钠使用玻璃棒,向容量瓶中转移氢氧化钠溶液用到玻璃棒;(Ⅲ)根据实验操作排列实验步骤;(3)根据![]() 分析误差。
分析误差。
解析:(1)根据m=cvM,需要NaOH固体的质量为0.5L×0.5 mol·L-1×40g/mol= 10.0g;(2)(Ⅰ)操作步骤有计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等,所以需要①烧杯 、④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码),不需要②100ml量筒 、③1000ml容量瓶、⑦滴定管;定容时用胶头滴管,还缺少的仪器是胶头滴管;(Ⅱ)溶解氢氧化钠固体时,为加快氢氧化钠溶解,使用玻璃棒搅拌;向容量瓶中转移氢氧化钠溶液用玻璃棒引流。
(Ⅲ)操作步骤有计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等操作,所以实验操作步骤的正确顺序为②①③⑧⑤⑥⑦④;(3)A.使用滤纸称量氢氧化钠固体,部分氢氧化钠粘在滤纸上,氢氧化钠质量偏小,溶液浓度偏小;B.容量瓶中原来存有少量蒸馏水,无影响;C.溶解后的烧杯未经多次洗涤,氢氧化钠质量偏小,溶液浓度偏小;D.胶头滴管加水定容时俯视刻度线,溶液体积偏小,浓度偏大,故选AC。


科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,欲测定Na2O2试样的纯度。可供选用的反应物只有CaCO3固体、6mol·L-1硫酸、6mol·L-1盐酸和蒸馏水。已知:①浓硫酸有吸水性、脱水性和强氧化性,②碱石灰的成分为CaO和NaOH。实验方案为:①制备并提纯CO2。②将纯净的CO2通过试样。③测定生成O2的体积。④根据O2的体积计算Na2O2试样的纯度。实验装置如下:

回答下列问题:
(1)装置A中发生反应的离子方程式是______________________________________。
(2)装置B的作用是_______________________,装置C的作用是_______。
(3)装置E的作用是__________________________________________
(4)装置D中发生反应的化学方程式是______________________________________。
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们发现PtCl2(NH3)2有两种不同性质的异构体,性质如下表:请回答下列问题:
配合物 | 颜色 | 在水中的溶解 | 抗癌活性 |
PtCl2(NH3)2 | 黄绿色 | 0.2577g/100gH2O | 有活性 |
PtCl2(NH3)2 | 淡黄色 | 0.0360g/100gH2O | 无活性 |
(1)PtCl2(NH3)2的空间结构是______________;
(2)根据它们的性质分析,淡黄色固体是________________(填“极性分子”或“非极性分子”)。
(3)请画出黄绿色固体分子的几何构型图:__________________;
(4)黄绿色固体在水中溶解度较大的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应为:Cu+2Fe3+==Cu2++2Fe2+,下列能实现该反应的原电池是
A | B | C | D | |
电极材料 | Cu、C | Cu、Ag | Cu、Zn | Fe、Zn |
电解质溶液 | Fe(NO3)3 | FeSO4 | FeCl3 | CuSO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3=4N2↑+2HNO3+9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:__________________。
处理CN一还常用的一种方法是:用ClO一氧化处理生成CNO一,反应的离子方程式如下;
aCN-+bClO-+ 2cOH一=dCNO-+eN2↑+fCO32-+bCl-+cH2O
上述化学方程式可能的配平化学计量数有多组,回答下列问题:
①方程式中e:f的值为_________(填字母);
A.1 B.1/2 C.2 D.不能确定
②若d=e=l,则b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
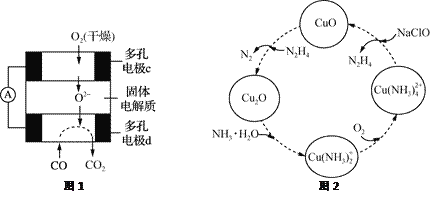
①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________
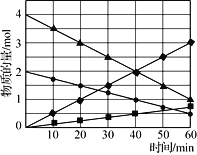
图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~ 100nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A. ①④⑥ B. ②③④ C. ②③⑤ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示: 下列有关说法正确的是

A.该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.沉淀乙一定有BaCO3,可能有BaSO4
D.一定没有Fe3+,但是无法确定是否含有I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①溴水 ②氯水 ③碘酒 ④氯化钾 ⑤酸性高锰酸钾溶液。能使湿润的淀粉KI试纸变蓝的是( )
A. ①②③ B. ①⑤ C. ①②③⑤ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com