
| A. | 容量瓶、10mL量筒 | B. | 容量瓶、100mL量筒 | ||
| C. | 100mL容量瓶、50mL量筒 | D. | 100mL容量瓶、10mL量筒 |
分析 操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,根据配制一定物质的量浓度的溶液的操作步骤选择仪器,以此解答该题.
解答 解:该浓硫酸的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
配制100mL 1mol/L的稀硫酸,需要浓硫酸的体积为:$\frac{0.1L×1mol/L}{18.4mol/L}$≈0.0136L=0.0054mL,应该选用10mL量筒;
配制100mL 1mol/L的稀硫酸,应该选用100mL容量瓶,
故选D.
点评 本题考查配制一定物质的量浓度的溶液中选用仪器的方法,为高频考点,侧重考查学生的分析能力和实验能力,题目难度中等,注意掌握物质的量浓度与溶质质量分数之间的转化,明确配制一定物质的量浓度的溶液方法及选用仪器规格的原则.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:填空题
 用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三处 | B. | 四处 | C. | 五处 | D. | 六处 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
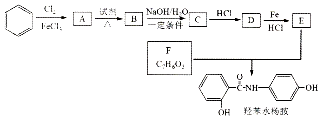
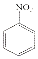 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$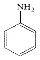
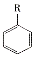 (R-烷基)$\stackrel{KMnO_{4}/H+}{→}$
(R-烷基)$\stackrel{KMnO_{4}/H+}{→}$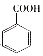
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$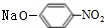 +NaCl+H2O.
+NaCl+H2O.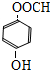 .
.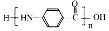 的合成路线
的合成路线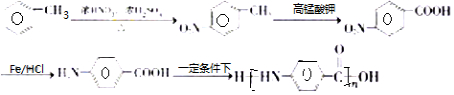 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L HF中含有的电子数为10NA | |
| B. | 在一定条件下,1molSO2和0.5molO2在密闭容器中充分反应,转移电子数目为2NA | |
| C. | 常温常压下,32gN2H4中含有的共价键数目为5NA | |
| D. | 某饱和FeCl3溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )| A. | NaHCO3溶液的物质的量浓度为0.8 mol/L | |
| B. | b点与c点溶液所含微粒种类相同 | |
| C. | a点溶液中存在的离子是Na+、AlO2-、OH-、H+ | |
| D. | 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第ⅤA族 | B. | 第四周期第ⅤA族 | C. | 第五周期第ⅢA族 | D. | 第四周期第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 得到2.54g沉淀时,加入NaOH溶液的体积是600L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com