
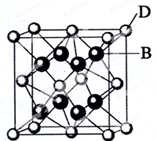
 已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:
已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:分析 A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.E是周期表中1-18列中E排第7列,只能处于第四周期,故E为Mn;D和E属同一周期,D的原子序数比E小5,则D的原子序数为20,故D为Ca元素,图中离子化合物D与B的离子个数比值为:(8×$\frac{1}{8}$+6×$\frac{1}{2}$):8=1:2,且D为Ca,则B的化合价为-1价,应为第ⅦA族元素,B和C属同一主族,C的原子序数大于B,故B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H元素,据此解答.
解答 解:A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.E是周期表中1-18列中E排第7列,只能处于第四周期,故E为Mn;D和E属同一周期,D的原子序数比E小5,则D的原子序数为20,故D为Ca元素,图中离子化合物D与B的离子个数比值为:(8×$\frac{1}{8}$+6×$\frac{1}{2}$):8=1:2,且D为Ca,则B的化合价为-1价,应为第ⅦA族元素,B和C属同一主族,C的原子序数大于B,故B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H元素.
(1)由上述分析可知,A为H元素,故答案为:H;
(2)HF分子之间存在氢键,HCl分子之间为范德华力,氢键比范德华力强,故HF的沸点高于HCl,
故答案为:HF分子之间存在氢键,HCl分子之间为范德华力,氢键比范德华力强;
(3)E为Mn元素,原子的核外电子的排布式为1s22s22p63s23p63d54s2,失去2个电子形成Mn2+离子,Mn2+离子电子排布式为 1s22s22p63s23p63d5,
故答案为:锰;1s22s22p63s23p63d5;
(4)从图中可以看出,晶胞中含有Ca的离子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有F的离子个数为8,二者比值为1:2,则化学式为CaF2,以上面心D研究,为2个晶胞共用,故在晶体中与D距离最近且相等的B有8个,由于离子半径F-<Cl-,故CaF2的晶格能大于CaCl2,故CaF2的熔点更高,
故答案为:CaF2;8;>.
点评 本题是对物质结构的考查,涉及核外电子排布、氢键、晶胞计算、晶体熔沸点比较等,推断元素是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 | 8960mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的结构式:O=C=O | B. | 氮气的电子式: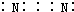 | ||
| C. | 钙离子的电子式:Ca2+ | D. | Na的原子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | T/℃ | 大理石 规格 | HNO3浓度 (mol?L-1) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
| ② | ||||
| ③ | 粗颗粒 | 2.00 | ||
| ④ | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
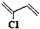 )是制备氯丁橡胶的原料,它只比1,3-丁二烯(
)是制备氯丁橡胶的原料,它只比1,3-丁二烯( )多了一个氯原子,但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得,2-氯-1,3-丁二烯的逆合成分析为:
)多了一个氯原子,但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得,2-氯-1,3-丁二烯的逆合成分析为: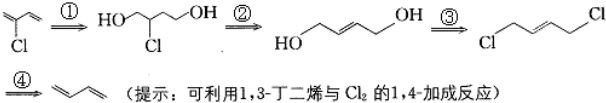
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的氧化物是碱性氧化物 | |
| B. | D与A能形成原子个数比为1:1型的离子化合物 | |
| C. | 最高价氧化物对应水化物的酸性:B>A | |
| D. | 工业上电解由A,C两种元素组成的化合物制备C单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-=CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(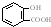 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: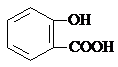 +HCO3-→ +HCO3-→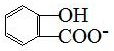 +CO2↑+H2O +CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com