
【题目】某烃A不能使溴水褪色,0.5 mol A完全燃烧时,得到1.5 mol H2O和67.2 L CO2(标准状况)。
(1)通过计算确定A的结构简式为__________________。
(2)写出A与浓硝酸和浓硫酸的混合酸在水浴加热条件下反应生成C的化学方程式:_______________________________________。
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有机物中,核磁共振氢谱中出现三组峰,且峰面积之比为:2:2:1的是( )
A.CH3CH2CH2OH
B.CH3OCH3
C.CH2=CH﹣CH3
D.一氯苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究.在相同温度下,M的物质的量浓度(molL﹣1)随时间(min)变化的有关实验数据见表.下列说法不正确的是( )
时间 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Ca2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
A.在0~20 min内,Ⅰ中M的分解速率为0.015 molL﹣1min﹣1
B.水样酸性越强,M的分解速率越快
C.在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大
D.由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有:K+、Na+、Clˉ、CO32﹣、SO42﹣等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是( ) 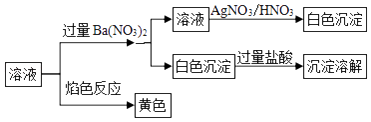
A.该混合物一定是K2CO3和NaCl
B.该混合物可能是Na2CO3和KCl
C.该混合物可能是Na2SO4和Na2CO3
D.该混合物一定是Na2CO3和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法制备NaClO2固体的实验装置如图1所示. 已知:2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O
ClO2熔点﹣59℃、沸点11℃;H2O2沸点150℃
请回答:
(1)仪器A的作用是;冰水浴冷却的目的是(写两种).
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因
(3)Clˉ存在时会催化ClO2的生成.反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气.该过程可能经两步完成,请将其补充完整:①(用离子方程式表示),②H2O2+Cl2═2Cl﹣+O2+2H+ .
(4)H2O2浓度对反应速率有影响.通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备.该设备的作用是 , 馏出物是 .
(5)抽滤法分离NaClO2过程中,下列操作不正确的是
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管,关闭水龙头.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成镇痛药哌替啶: 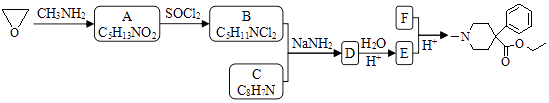
已知RX ![]() RCN
RCN ![]() RCOOH
RCOOH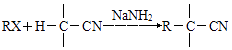
请回答:
(1)A→B的反应类型是 .
(2)下列说法不正确的是 .
A.化合物A的官能团是硝基
B.化合物B可发生消去反应
C.化合物E能发生加成反应
D.哌替啶的分子式是C15H21NO2
(3)写出B+C→D的化学反应方程式 .
(4)设计以甲苯为原料制备C的合成路线(用流程图表示,无机试剂任选) .
(5)写出同时符合下列条件的C的所有同分异构体的结构简式 . ①分子中有苯环而且是苯环的邻位二取代物;
②1H﹣NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第周期第族.
(2)N原子的原子结构示意图为;Cu的低价氧化物的颜色为 .
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
AlSi | NO | 金刚石晶体硅 | CH4SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生. 
0﹣t1时,原电池的负极是Al片,此时,正极的电极反应式是 , 溶液中的H+向极移动,t1时,原电池中电子流动方向发生改变,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色植物是空气天然的“净化器”,研究发现,1亩柳杉每天可以吸收5mol SO2 . 则1亩柳杉每天吸收的SO2的质量为( )
A.320g
B.160g
C.64g
D.32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3 ![]() 2Fe+Al2O3 , 反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
2Fe+Al2O3 , 反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的反应.
(2)信息中的“某些”指(填“比铝活泼的”“比铝不活泼的”或“任意”).
(3)试写出铝粉与MnO2发生的铝热反应方程式 .
(4)铝热反应可用于野外焊接钢轨,原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com