
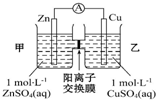
| A. | 铜电极上发生反应Cu-2e-=Cu2+ | |
| B. | 电池工作一段时间后,乙池的c(SO42- )减小 | |
| C. | 电子从锌极经过导线移向铜极 | |
| D. | 电池工作一段时间后,甲池的c(Zn2+ )增加 |
分析 由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn失电子发生氧化反应,为负极,Cu电极上铜离子得电子发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,电子从负极流向正极,据此分析.
解答 解:A.由图象可知,铜锌原电池的电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,正极上铜离子得电子生成Cu,则铜电极上发生反应Cu2++2e-=Cu,故A错误;
B.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B错误;
C.电子从负极流向正极,即电子从锌极经过导线移向铜极,故C正确;
D.甲池中Zn失电子生成Zn2+,Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,所以甲池的c(Zn2+ )不变,故D错误,
故选:C.
点评 本题考查原电池工作原理,侧重于学生的分析能力的考查,注意把握原电池的工作原理,题目难度中等,注意阳离子交换膜不允许阴离子通过.


科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达平衡时,两个容器中XY3的物质的量浓度均为1mol•l-1 | |
| C. | 容器②中反应达到平衡时放出的热量为Q | |
| D. | 若将容器①体积缩小为0.40 L,则达平衡时放出的热量大于23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 2.8L | D. | 13.44L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜粉中混有铁粉:加入过量盐酸充分反应,过滤 | |
| B. | CO2中混有HCl:将其通入NaOH溶液,洗气 | |
| C. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| D. | FeCl2溶液中混有少量FeCl3:加入Fe粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com