
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2SO4(浓) |
| 170℃ |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 色、态 | 无色液体 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/(g?cm-3) | 0.79 | 2.2 | 0.71 | 3.1 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 59.47 |
| 熔点/℃ | -130 | 9 | -116 | -7.25 |
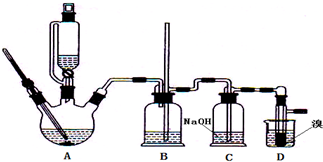
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)I 选择下列实验方法分离物质,将分离方法的序号依次为
①分离水和四氯化碳的混合物;②分离氯化钾溶液和沙子的混合物;
③从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
④ 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
⑤分离食盐和碘的混合物; ⑥ 从碘水中提取碘单质。
A.过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华
II 、长期存放在Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。
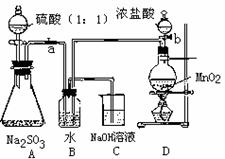
请回答:(1)写出B装置中反应的离子方程式
(2)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(3)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:
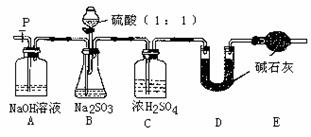
(4)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(5)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(6)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量盐酸,再加足量Ba(NO3)2溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将滤液蒸干,称量得固体m3g
D.将样品溶液,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。为完成测定并验证有NO生成,有人设计下图实验装置。
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是________________________________________________。
(2)装置B瓶的作用是___________________________________________。
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人_______________(填“冷”或“热”)的氧气。
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是:___________________________________________________。
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1。实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________。
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程_______________ ____。
【解析】本实验的目的有两个。一是验证反应中除生成NO2气体外还有少量的NO生成,二是测定某铜银合金中铜的质量分数,解题时我们始终围绕这两个目的。要验证有NO生成,就必须要保证整个装置中没有氧气存在,否则即使生成NO,也会转变成NO2,所以实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是排尽装置中的空气。检验NO的方法是将NO与O2反应生成红棕色的NO2,由于反应中本来就生成NO2,所以必须将NO2与NO分离,结合题目不难得到装置C的作用就是将NO2转变成无色N2O4液体或晶体。如果温度过低NO2会转变成无色N2O4液体或晶体,所以为了便于观察应通人热的氧气。要测定某铜银合金中铜的质量分数除知道铜银合金的质量外,还必须测得与铜银合金相关的另外一个量,方可列方程组求解。结合题意,可知方法为测出氮的氧化物的质量。由于氮的氧化物存在于C、E两个装置中,所以必须测出两个装置的质量变化。另为保证测定准确,在A中反应完成和D中出现现象后,还应打开K1、K2,持续一段时间的N2和O2,以保证氮的氧化物被充分吸收。计算参加反应的硝酸的物质的量可以利用原子守恒进行计算,反应后剩余硝酸是0.04mol,反应前硝酸是0.04L×13.5mol/L=0.54mol,剩余参加反应的硝酸是0.5mol。因为溶液中含有银离子,剩余可以通过沉淀法来测定银的物质的量。
查看答案和解析>>
科目:高中化学 来源:2014届河北省高一下学期期中考试化学试卷(解析版) 题型:实验题
(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。为完成测定并验证有NO生成,有人设计下图实验装置。
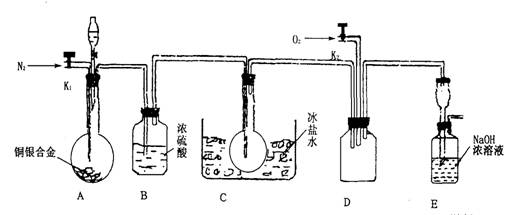
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是________________________________________________。
(2)装置B瓶的作用是___________________________________________。
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人_______________(填“冷”或“热”)的氧气。
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是: ___________________________________________________。
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1。实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________。
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程_______________ ____。
【解析】本实验的目的有两个。一是验证反应中除生成NO2气体外还有少量的NO生成,二是测定某铜银合金中铜的质量分数,解题时我们始终围绕这两个目的。要验证有NO生成,就必须要保证整个装置中没有氧气存在,否则即使生成NO,也会转变成NO2,所以实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是排尽装置中的空气。检验NO的方法是将NO与O2反应生成红棕色的NO2,由于反应中本来就生成NO2,所以必须将NO2与NO分离,结合题目不难得到装置C的作用就是将NO2转变成无色N2O4液体或晶体。如果温度过低NO2会转变成无色N2O4液体或晶体,所以为了便于观察应通人热的氧气。要测定某铜银合金中铜的质量分数除知道铜银合金的质量外,还必须测得与铜银合金相关的另外一个量,方可列方程组求解。结合题意,可知方法为测出氮的氧化物的质量。由于氮的氧化物存在于C、E两个装置中,所以必须测出两个装置的质量变化。另为保证测定准确,在A中反应完成和D中出现现象后,还应打开K1、K2,持续一段时间的N2和O2,以保证氮的氧化物被充分吸收。计算参加反应的硝酸的物质的量可以利用原子守恒进行计算,反应后剩余硝酸是0.04mol,反应前硝酸是0.04L×13.5mol/L=0.54mol,剩余参加反应的硝酸是0.5mol。因为溶液中含有银离子,剩余可以通过沉淀法来测定银的物质的量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com