
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。

【答案】(1)增大接触面积,加快反应速率,使反应更充分;
(2)Fe3++2H2O![]() FeO(OH)↓+3H+,SiO2、CaSO4;
FeO(OH)↓+3H+,SiO2、CaSO4;
(3)0.5,Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O;(4)2.0×10-3;(5)0.25。
2Cr3++6Fe3++7H2O;(4)2.0×10-3;(5)0.25。
【解析】
试题分析:(1)混合研磨,增大接触面积,加快反应速率,使反应更充分;(2)放在95℃热水中浸泡,使Fe3+发生水解,即离子反应方程式为:Fe3++2H2O![]() FeO(OH)↓+3H+,SiO2不溶于水,Ca2+和SO42-生成微溶于水的CaSO4,因此浸渣中除Fe2O3、FeO(OH)外,还有SiO2和CaSO4;(3)根据得失电子数目守恒,n(Sn2+)×2=n(Fe3+)×1,解得n(Sn2+)/n(Fe3+)=0.5,K2Cr2O7→Cr3+,化合价降低3价,共降低6价,Fe2+→Fe3+,化合价升高1价,升高1价,最小公倍数为6,因此离子反应方程式为:Cr2O72-+6Fe2++14H+
FeO(OH)↓+3H+,SiO2不溶于水,Ca2+和SO42-生成微溶于水的CaSO4,因此浸渣中除Fe2O3、FeO(OH)外,还有SiO2和CaSO4;(3)根据得失电子数目守恒,n(Sn2+)×2=n(Fe3+)×1,解得n(Sn2+)/n(Fe3+)=0.5,K2Cr2O7→Cr3+,化合价降低3价,共降低6价,Fe2+→Fe3+,化合价升高1价,升高1价,最小公倍数为6,因此离子反应方程式为:Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O;(4)除钙后溶液中c(Ca2+)=1.0×10-3×1%mol·L-1=1.0×10-5mol·L-1,Ksp=c(Ca2+)×c2(F-),c(F-)=2.0×10-3mol·L-1;(5)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图像,最佳取值为0.25。
2Cr3++6Fe3++7H2O;(4)除钙后溶液中c(Ca2+)=1.0×10-3×1%mol·L-1=1.0×10-5mol·L-1,Ksp=c(Ca2+)×c2(F-),c(F-)=2.0×10-3mol·L-1;(5)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图像,最佳取值为0.25。


科目:高中化学 来源: 题型:
【题目】A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A、B、C三种元素的离子半径大小顺序是( )
A.A>B>CB.B>A>CC.C>A>BD.C>B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子①F- ②Na+ ③HF ④NH3⑤CH4其中与氖原子含有相同电子数的是( )
A. ①②③ B. ②③④ C. ①②⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组对碳与浓硝酸的反应进行探究,已知:2NaOH+2NO2=NaNO3+NaNO2+H2O,2NaOH+NO2+NO=2NaNO2+H2O。请回答下列可题:
I.甲同学设计 如图所示装置制备并收集NO
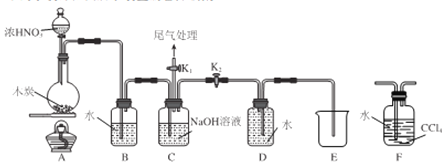
(1)碳与浓硝酸反应的化学方程式为__________________。
(2)C的作用为_______________。
(3)乙同学认为用装置F代替B更合理,理由为_______________。
(4)乙同学用改进后的装置进行实验。
①将浓HNO3滴入圆底烧瓶中的操作为__________________。
②点燃A处酒精灯开始反应后,圆底烧瓶中的现象为________________。
II.探究NO与Na2O2反应
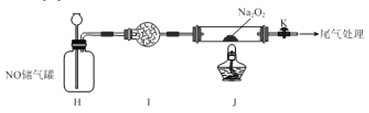
已知NaNO2既有氧化性,又有还原性;J 处硬质玻璃管中制得的NaNO2中含有少量NaNO3。
(5)检验上图装置气密性的方法为____________________。
(6)实验结束后,设计实验证明J 处硬质玻璃管中有NaNO2生成________________。
供选试剂:蒸馏水KI-淀粉溶液,KMnO4溶液、NaOH溶液.BaCl2溶液、稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用托盘天平称取1.06gNa2CO3固体
B.用10mL量筒量取8.58mL蒸馏水
C.用稀盐酸洗净做焰色反应的铁丝
D.为了加快过滤的速率,用玻璃搅拌过滤器中的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味。请回答以下问题:

(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极为电源的_________极(填“正”或“负”),电极反应为___________________________;
(2)电解饱和食盐水的离子反应方程式是__________________;
(3)电极C的电极反应是_____________________________________________;
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从______极区移向_____极区(填“C”或“D”);
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合你所学的知识模拟该过程,下列哪种材质的手术刀触碰铁盘上的青蛙腿不会产生触动_________(填字母)。
a、铝 b、玻璃 c、银 d、铁
(2)1799年,伏打仔细研究了伽伐尼的发现,以含食盐水的湿抹布,夹在银和锌的圆形版中间,堆积成圆柱状,制造出世界上最早的电池-伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:

金属 | 电子流动方向 | 电压(V) |
A | A→Cu | +0.78 |
B | Cu→B | -0.15 |
D | D→Cu | +1.35 |
E | E→Cu | +0.30 |
已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据表中数据判断:_______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,下图是丹尼尔电池的简易装置:

该电池的正极反应是_____________,负极反应 __________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它的正极反应为:Fe3++e-=Fe2+以“![]() ”代表反应容器,“
”代表反应容器,“![]() ”代表导线,“
”代表导线,“![]() ”代表电极,“
”代表电极,“![]() ”代表小灯泡,
”代表小灯泡,
在下图方框内画出装置图并指出电极材料和电解质溶液,标出电源的正负极________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL浓度为2mol/L的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是( )
A. 加入适量的6mol/L的硫酸 B. 适当加热
C. 加入适量蒸馏水 D. 加入适量的稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物H是一种可用于治疗肿瘤的药物,其合成路线如图所示:
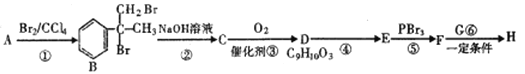
已知:
(1) E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色
(2) H的结构简式为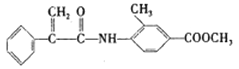
(3) RCOOH![]() (R为烃基)
(R为烃基)
(4) 
请回答下列问题:
(1)A的苯环上有____种不同化学环境的氢原子。
(2)④的反应条件是________该反应的类型是_______;l molH最多可以和____mol NaOH 反应。
(3)G的结构简式为__________。
(4)D在一定条件下可以聚合形成高分子,写出该反应的化学方程式__________。
(5)E有多种同分异构体,同时满足下列条件的E且含有苯环的同分异构体有_____种。
①能发生银镜反应 ②能发生水解反应 ③分子中含的环只有苯环
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2 为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com