
| A. | 溴水中当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 高压比常压有利于工业合成氨反应 | |
| C. | 红棕色NO2加压后颜色比原来要深 | |
| D. | 热的纯碱除油污效果好 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.溴水中有下列平衡:Br2+H2O?HBr+HBrO,加入硝酸银溶液后,会和HBr反应生成AgBr沉淀,所以平衡正向移动,溶液颜色变浅,能用勒夏特列原理解释,故A不选;
B.合成氨的正反应是一个反应前后气体体积减小的可逆反应,增大压强平衡正向移动,所以高压比常压有利于工业合成氨反应,可以用勒夏特里原理解释,故B不选;
C.对2NO2?N2O4平衡体系增加压强,平衡正向移动,颜色变浅,但变浅后的颜色仍然比原来颜色深,不能用勒夏特列原理解释,故C选;
D.升高温度促进纯碱水解导致溶液碱性增强,则除油污效果更好,可以用勒夏特列原理解释,故D故选;
故选C.
点评 本题考查了化学平衡移动原理的分析判断,为高频考点,侧重于学生的分析能力的考查,影响因素的分析,平衡移动原理的理解是解题关键,易错选项是C.


科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
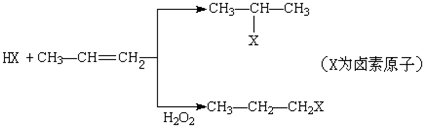
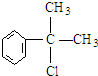
 的物质,该物质是一种香料.
的物质,该物质是一种香料.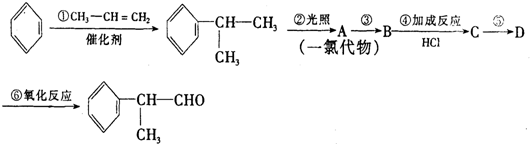
 ,
, .
.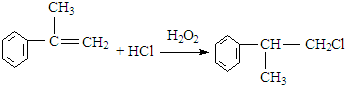 .反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):
.反应⑤的化学方程式为(有机物写结构简式,并注明反应条件): +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$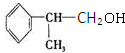 +NaCl.
+NaCl.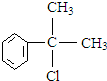 的水解产物
的水解产物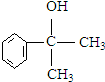 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. ,
, ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
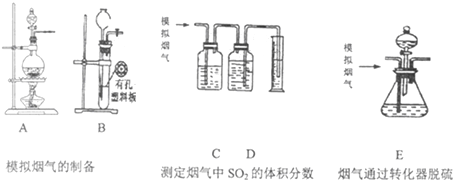
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Fe(OH)3中加入氢溴酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向NaHCO3溶液中加入过量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4是还原剂 | B. | Na被氧化 | ||
| C. | Na得到电子 | D. | TiCl4发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com