
| A. | ②④⑥ | B. | ①②④ | C. | ①③⑤⑥ | D. | ②③④⑤ |
分析 ①二氧化硫和氯化钡溶液不发生反应;
②氢氧化铁胶体中滴入硫酸溶液先发生胶体聚沉,后沉淀溶解;
③向Na[Al(OH)4]溶液中逐滴加入过量的AlCl3溶液生成氢氧化铝沉淀;
④澄清石灰水中通入过量二氧化硫先生成亚硫酸钙沉淀,继续通入会生成亚硫酸氢钙;
⑤向硅酸钠溶液中通入过量的CO2,生成硅酸沉淀;
⑥向AgNO3溶液中逐滴加入过量的氨水,显生成氢氧化银沉淀,继续滴加沉淀溶解生成银氨溶液.
解答 解:①二氧化硫和氯化钡溶液不发生反应,无先沉淀后溶解现象,故①不符合;
②氢氧化铁胶体中滴入硫酸溶液先发生胶体聚沉,后沉淀溶解,符合先沉淀后溶解现象,故②符合;
③向Na[Al(OH)4]溶液中逐滴加入过量的AlCl3溶液,只能生成氢氧化铝沉淀,故③不符合;
④澄清石灰水中通入过量二氧化硫先生成亚硫酸钙沉淀,继续通入会生成亚硫酸氢钙,符合先沉淀后溶解现象,故④符合;
⑤向硅酸钠溶液中通入过量的CO2,生成硅酸沉淀,不符合先沉淀后溶解现象,故⑤不符合;
⑥向AgNO3溶液中逐滴加入过量的氨水,先生成氢氧化银沉淀,继续滴加沉淀溶解生成银氨溶液,符合先沉淀后溶解现象,故⑥符合;
故选A.
点评 本题考查了物质性质的分析应用,主要是物质反应过程中量不同,产物不同的理解应用,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
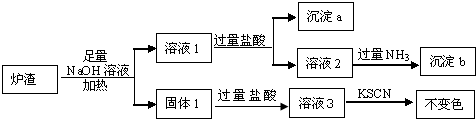
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始加入的C(s)与H2O(g)物质的量为2:1 | |
| B. | 若增大压强,H2O(g)转化率不变化 | |
| C. | 达到平衡后混合气体平均式量可能为16 | |
| D. | 开始反应后混合气体平均式量一直减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题:
已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题: .画出G离子的结构示意图
.画出G离子的结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.05g | B. | 5.4 g | C. | 2.7g | D. | 8.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是氧化剂 | ||
| C. | 维生素C将Fe3+还原为Fe2+ | D. | 亚硝酸盐被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 降低温度 | B. | 减小压强 | C. | 减小SO3的浓度 | D. | 增大压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com