
【题目】下列实验步骤是兴趣小组对某混合样品含量的测定,样品成分为FeO、FeS2、SiO2、及其它杂质,杂质不与酸碱反应,受热稳定。(步骤中所加试剂均为足量)
①称量mg样品灼烧。装置如下:
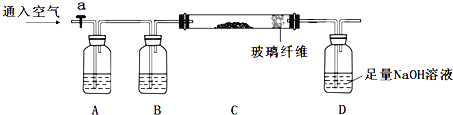
②D瓶溶液![]()
![]()
![]() 固体(ag)
固体(ag)
③![]()
请回答下列问题:
(1)连接好仪器后,如何检查整套装置的气密性_______________。
(2)A瓶内所盛试剂是__________溶液。灼烧完成后熄灭酒精灯,若立即停止通空气,可能对实验的影响是(写两点) _________________________。
(3)步骤②中加入双氧水的离子方程式为____________________。若此步骤不加入双氧水对测定硫元素含量的影响是_____________(填“偏高”、“偏低”或“无影响”)。
(4)连续操作1为_________、洗涤、_________、称量;连续操作2为洗涤、_________、称量。
(5)从步骤③的bg滤渣入手,可测定SiO2的含量,下面各组试剂中不适合测定的是___________。
A.NaOH溶液 、稀硫酸 B.Ba(OH)2溶液、盐酸 C.氨水、稀硫酸 D.NaOH溶液、盐酸
(6)求样品中FeO的质量分数(列出算式即可)____________________。
【答案】(1)向D中加水浸没导管,夹紧止水夹a,微热C,导管口有气泡,停止微热后,若D导管中形成一段稳定的水柱,则气密性良好;
(2)氢氧化钠(氢氧化钾、或其他合理答案);D中溶液倒吸、SO2不能全部排出(或测得硫元素的含量偏低);
(3)SO32-+H2O2=SO42-+H2O;偏高;
(4)过滤、干燥(烘干);灼烧(填“干燥(烘干)”不给分)
(5)BC;
(6) 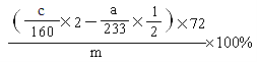 ;
;
【解析】
试题分析:样品成分为FeO、FeS2、SiO2、及其它杂质,杂质不与酸碱反应,受热稳定,mg样品灼烧FeS2燃烧生成Fe2O3和SO2。
①A瓶是氢氧化钠溶液吸收空气中的二氧化碳等酸性气体,B装置是浓硫酸干燥气体,C装置是样品灼烧得到氧化铁固体和二氧化硅,装置D是吸收生成的二氧化硫气体生成亚硫酸钠;
②D瓶中加入过氧化氢氧化亚硫酸钠为硫酸钠,加入氯化钡溶液形成硫酸钡沉淀,过滤、洗涤、干燥得到固体为BaSO4ag;
③C中固体为FeO、Fe2O3和SiO2和其他杂质,加入稀硫酸溶解生成硫酸亚铁、硫酸铁溶液,过滤得到滤渣为SiO2和其他杂质bg,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入氢氧化钾溶液沉淀铁离子为Fe(OH)3,过滤得到滤渣洗涤干燥后灼烧得到红褐色固体Fe2O3质量为cg;
(1)检查整套装置的气密性,先连接好仪器后,关闭紧止水夹a,微热C,依据导气管气泡冒出,停止加热导气管中有水柱上升证明气密性完好,具体步骤为:向D中加水浸没导管,夹紧止水夹a,微热C,导管口有气泡,停止微热后,若D导管中形成一段稳定的水柱,则气密性良好;故答案为:向D中加水浸没导管,夹紧止水夹a,微热C,导管口有气泡,停止微热后,若D导管中形成一段稳定的水柱,则气密性良好;
(2)上述分析可知A中是氢氧化钠溶液,用来吸收通入空气中二氧化碳,避免影响后续实验测定,灼烧完成后熄灭酒精灯,若立即停止通空气,可能会引起倒吸,生成的二氧化硫不能全部进入装置D中吸收等;故答案为:氢氧化钠,D中溶液倒吸、SO2不能全部排出或测得硫元素的含量偏低;
(3)过氧化氢是氧化亚硫酸根离子为硫酸根离子全部沉淀,步骤②中加入双氧水的离子方程式为:SO32-+H2O2=SO42-+H2O,如不加入过氧化氢氧化,生成的沉淀含有BaSO3,称量过程中易被空气中氧气氧化,计算得到硫元素质量偏高;故答案为:SO32-+H2O2=SO42-+H2O,偏高;
(4)依据上述分析可知,实验过程中连续操作1是过滤、洗涤、干燥、称量;连续操作2是洗涤、干燥、灼烧、称量;故答案为:过滤,干燥,灼烧;
(5)③C中固体为FeO、Fe2O3和SiO2和其他杂质,加入稀硫酸溶解生成硫酸亚铁、硫酸铁溶液,过滤得到滤渣为SiO2和其他杂质bg,杂质不与酸碱反应,受热稳定,从步骤③的bg滤渣入手,可测定SiO2的含量是利用加入的试剂溶解二氧化硅后过滤得到不溶性杂质,滤液中加入酸沉淀硅酸根离子形成硅酸沉淀,洗涤干燥称量,元素守恒计算得到二氧化硅质量,得到二氧化硅的含量;A.NaOH溶液、以溶解二氧化硅,稀硫酸和硅酸钠反应生成硅酸沉淀,可以测定二氧化硅含量,故A符合;B.Ba(OH)2溶液和二氧化硅反应生成硅酸钡是沉淀,不能和杂质分离、不能用来测定含量,故B不符合;C.氨水不能溶解二氧化硅,不能分离不溶性杂质,故C不符合;D.NaOH溶液、以溶解二氧化硅,稀盐酸和硅酸钠反应生成硅酸沉淀,可以测定二氧化硅含量,故D符合;故答案为:BC;
(6)依据铁元素守恒分析计算,实验③中得到的固体是氧化铁质量为cg,实验②是FeS2中硫元素最后生成硫酸钡沉淀为ag,据此可以依据硫元素守恒计算原样品中FeS2的物质的量,原样品中FeO物质的量应是铁元素总物质的量减去FeS2中铁元素物质的量,氧化铁物质的量=![]() =
=![]() mol,含有铁元素物质的量=
mol,含有铁元素物质的量=![]() mol×2,依据硫元素守恒,Fe~FeS2~2H2SO4~2BaSO4,则FeS2中铁元素物质的量=
mol×2,依据硫元素守恒,Fe~FeS2~2H2SO4~2BaSO4,则FeS2中铁元素物质的量=![]() ×
×![]() mol,氧化亚铁FeO中铁元素物质的量=
mol,氧化亚铁FeO中铁元素物质的量=![]() mol×2-
mol×2-![]() ×
×![]() mol,得到氧化亚铁的质量分数为:
mol,得到氧化亚铁的质量分数为: ×100%;故答案为:
×100%;故答案为: ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式 。
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成两种气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
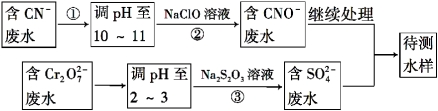
1)上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
2)②中反应后无气体放出,该反应的离子方程式为_______________________;
3)步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳循环正成为科学家研究 的主要课题。最近有科学家提出构想:把空气吹 入饱和碳酸钾溶液,然后再把CO2从溶液中提取 出来,经化学反应后使之变为可再生燃料甲醇。 该构想技术流程如下:
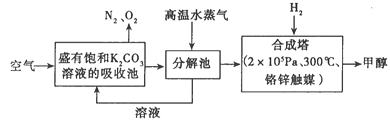
(1)向分解池中通入高温水蒸气的作用是________________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________。
(3)依据甲醇燃烧的反应原理。设计如右图所示的电池装置。该装置负极的电极反应式为____________。
(4)已知Ksp(CaCO3)=2.8×10-9mol2·L-2.现将CaCl2溶液与0.02 mol·L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为_____________。
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中发生反应:CO(g)+H2O(g)=CO2(g)+H2(g),不同温度下得到三组数据:
①实验1前6 min的反应速率v(CO2)=___________(保留小数点后两位,下同)。
②实验2条件下平衡常数K=_____________。
③该反应的△H____________0 (填“<”或“>”=。)
④实验3中,若平衡时的转化率α(CO)>α(H2O),则a/b的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代有“银针验毒”的记载。“银针验毒”的反应原理之一是4Ag+2H2S+O2=2X+2H2O。下列有关该反应的说法正确的是( )
A. Ag得到电子 B. X为AgS
C. O2被还原 D. 每生成1 mo1X转移电子数4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如右图所示。图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。已知:
①F的原子序数为29,其余均为短周期主族元素;
②A的内层电子总数是最外层电子数的一半;
③C、E同主族且C原子最外层电子数是次外层电子数的3倍;
④D是金属性最强的短周期元素。完成下列问题
(1)F在元素周期表的位置______________。
(2)B、C、D、E的原子半径由小到大顺序是_________ (用元素符号表示)。
(3)已知D在C的单质中燃烧生成淡黄色的固体化合物甲,甲的化学式为_______________,电子式为_______,甲中的化学键类型为____________________。
(4)A的单质与E的最高价含氧酸反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点
B.在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃
C.向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点
D.在t℃时,Ag2CrO4的Ksp为1×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A. CO2和H2O B. CCl4和KCl C. NaCl和HCl D. SO2和SiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com