
根据化学方程式:S(s)+O2(g)====SO2(g);ΔH=a kJ·mol-1(a=-297.2),在下列说法中,不正确的是( )
A.S(s)在O2(g)中燃烧的反应是放热反应
B.S(g)+O2(g)====SO2(g);ΔH=b kJ·mol-1,则a<b
C.在相同温度下,1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和
D.16 g固体硫在空气中充分燃烧,可放出148.6 kJ的热量
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
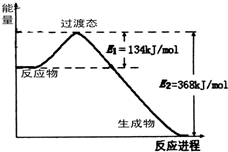 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料. 查看答案和解析>>
科目:高中化学 来源: 题型:
A.S(s)在O2(g)中燃烧的反应是放热反应
B.S(g)+O2(g)====SO2(g);ΔH=b kJ·mol-1,则a<b
C.在相同温度下,1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和
D.16 g固体硫在空气中充分燃烧,可放出148.6 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com