
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol分析 (1)反应热=反应物的总键能-生成物的总键能,以此解答;
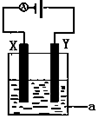
(2)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应;
(3)原电池中,正极上氧化剂得电子发生还原反应;
(4)①若电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,据此写出电池反应式,根据铜和转移电子正极的关系式计算;
②根据转移电子守恒计算阴极上析出的物质,再根据氧气计算生成的C(H+),从而得出其pH;
③工业精炼铜时,阳极是粗铜,电解液为含铜离子的溶液.
解答 解:(1)已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,令N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,
解得:x=945.6 kJ/mol,故答案为:945.6 kJ/mol;
(2)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应,
A.该反应是吸热反应,所以不能设计成原电池,故不选;
B.该反应是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故选;
C.该反应不是氧化还原反应,所以不能设计成原电池,故不选;
故选:B;
(3)以KOH溶液为电解质溶液的氢氧燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)①电解硫酸铜溶液时,阳极上生成氧气,阴极上生成铜,同时溶液中生成硫酸,所以电池反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
②电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积=$\frac{0.04mol}{2}$=448mL<672mL,所以阳极上还有224mL氧气,阳极上转移电子的物质的量=0.04mol×1+$\frac{0.224L}{22.4L/mol}$=0.08mol,阴极上铜完全析出时,需要电子的物质的量=0.04mol×2=0.08mol,所以阴极上不析出氢气,生成224mL氧气时,阳极附近同时生成C(H+)=$\frac{\frac{0.224}{22.4}mol×4}{0.4L}$=0.1mol/L,所以溶液的pH=1,故答案为:1;
③工业精炼铜时,阳极是粗铜,电解液为含铜离子的溶液CuSO4或CuCl2,故答案为:CuSO4或CuCl2;Y.
点评 本题考查构成原电池的条件、电解池的有关计算等知识点,难点是(4)中溶液pH的计算,只有明确阴阳极上析出的物质才能正确解答,为易错点.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属性强弱:Na>Mg>Al | B. | 热稳定性:HCl>H2 S>PH3 | ||
| C. | 酸性强弱:HClO4>H2 SO4>H3PO4 | D. | 熔点:Na>SiO2>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Na+、SCN-、Cl- | B. | Na+、H+、NO3-、SO42- | ||
| C. | Na+、OH-、H+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①⑤⑥ | C. | ①③④⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验小组为探究SO2的漂白性和还原性,设计了以下实验.
实验小组为探究SO2的漂白性和还原性,设计了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
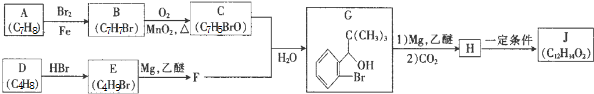
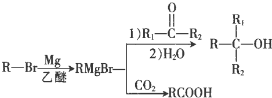
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$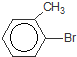 +HBr.,其反应类型为取代反应;
+HBr.,其反应类型为取代反应;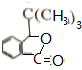 ,由D生成E的化学反应方程式为CH2=C(CH3)2+HBr→(CH3)3CBr;
,由D生成E的化学反应方程式为CH2=C(CH3)2+HBr→(CH3)3CBr;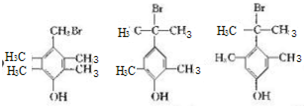 (其中一种)(写出一种即可).
(其中一种)(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖水解的产物只有葡萄糖 | |
| B. | 苯酚可用于合成高分子化合物 | |
| C. | 油脂水解可以制取高级脂肪酸 | |
| D. | 鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com