
| A. | 溶液和胶体的本质区别是否有丁达尔效应 | |
| B. | 用pH试纸测定某新制氯水的pH为4 | |
| C. | 酸性氧化物不一定都可与水反应生成酸,金属氧化物不一定是碱性氧化物 | |
| D. | 少量SO2和CO2气体分别通入BaCl2溶液中均有白色沉淀产生 |
分析 A.丁达尔效应为胶体特有的性质;
B.氯水中HClO具有漂白性;
C.二氧化硅与水不反应,过氧化钠不是碱性氧化物;
D.二者均与氯化钡不反应.
解答 解:A.丁达尔效应为胶体特有的性质,可用于鉴别溶液与胶体,但二者的本质区别为分散质的直径大小,故A错误;
B.氯水中HClO具有漂白性,不能利用pH试纸测定pH,应选pH计,故B错误;
C.二氧化硅与水不反应,过氧化钠不是碱性氧化物,则酸性氧化物不一定都可与水反应生成酸,金属氧化物不一定是碱性氧化物,故C正确;
D.二者均与氯化钡不反应,现象不合理,故D错误;
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意C中利用实例分析,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
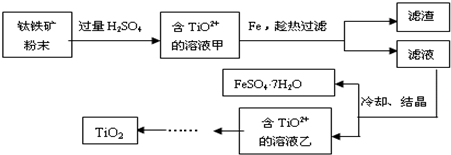
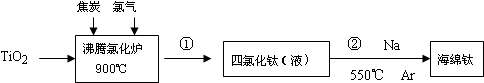

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “酸雨”、“温室效应”的形成都与化石燃料的燃烧有关 | |
| B. | NaHCO3是焙制糕点所用的发酵粉的主要成分之一 | |
| C. | 氢氧化铁胶体具有吸附性,因而常用于净水 | |
| D. | 硫酸钡在医学上用作钡餐,Ba2+对人体无毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+ | |
| B. | 加入氯化钡有白色沉淀产生,再加盐酸,沉淀不消失,该溶液一定有SO42- | |
| C. | 加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,则原溶液中一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~I为中学化学中常见的物质,B、E、F为单质,且在常温下B是一种黄绿色有毒气体,E为紫红色金属,G为黑色固体.它们的相互转化关系如图所示(部分生成物未列出).请回答下列问题:
A~I为中学化学中常见的物质,B、E、F为单质,且在常温下B是一种黄绿色有毒气体,E为紫红色金属,G为黑色固体.它们的相互转化关系如图所示(部分生成物未列出).请回答下列问题: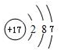 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | c(AlO2-)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

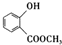 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式). )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com