
| A. | 该变化属于物理变化 | B. | 1mol 臭氧比 1mol 氧气的能量高 | ||
| C. | 空气中臭氧比氧气更稳定 | D. | 氧分子中的化学键断裂会放出能量 |
分析 A、有新物质生成的变化为化学变化;
B、常温下,氧气很难转化为臭氧,而在复印机工作的高温条件下,氧气可以转化为臭氧;
C、臭氧易分解;
D、化学键的断裂要吸收能量.
解答 解:A、有新物质生成的变化为化学变化,此反应有新物质生成,故为化学变化,故A错误;
B、常温下,氧气很难转化为臭氧,而在复印机工作的高温条件下,氧气可以转化为臭氧,故此反应为吸热反应,即1mol臭氧的能量高于1mol氧气的能量,故B正确;
C、臭氧易分解为氧气,即氧气比臭氧稳定,故C错误;
D、化学键的断裂要吸收能量,故氧气分子中的化学键断裂要吸收能量,故D错误.
故选B.
点评 本题考查了化学变化和物理变化的区别以及物质能量高低的判断能,难度不大,应注意的是臭氧在空气中易转化为氧气.


科目:高中化学 来源: 题型:选择题
| A. | SO2可用于杀菌、消毒 | |
| B. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 | |
| C. | 碘是人体必需微量元素,所以要多吃富含髙磷酸的食物 | |
| D. | 海水淡化的方法主要有蒸馏法、电解法、离子交换法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸溶液导电性比乙酸溶液导电性强,说明乙酸是弱酸 | |
| B. | 硫酸钾溶于水能导电,所以硫酸钾是电解质 | |
| C. | 强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 | |
| D. | 固态磷酸是电解质,所以磷酸在熔融状态下和水溶液中都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:CO2、SiO2、SO2、NO2 | |
| B. | 碱:NaOH、KOH、Ba(OH)2、纯碱 | |
| C. | 混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体 | |
| D. | 碱性氧化物:Na2O2、CaO、MgO、Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
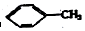 ②
②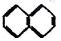 ③
③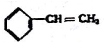 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦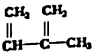 ⑧
⑧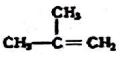
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤、⑦和⑧ | D. | ⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com