
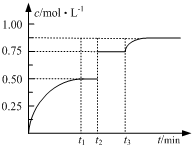
 һ���¶��£���1mol A��1mol B�������2L�����ܱ�������������Ӧ��
һ���¶��£���1mol A��1mol B�������2L�����ܱ�������������Ӧ��| A�� | ��t1=2����Ӧ��0��2 min�ڵ�ƽ������Ϊv��A��=0.50 mol•��L•min��-1 | |
| B�� | ��t3ʱ���������¶ȣ���÷�Ӧ�ġ�H��0 | |
| C�� | ��t1ʱ�̺�����ϵ�м���A��B��C��1 mol����ԣ��������ԣ��棩 | |
| D�� | �¶Ȳ��䣬����ʼ�������м���1 mol A��1 mol B��2 mol D�����ƽ��ʱA��ת����С��50% |
���� A�����A��Ũ�ȱ仯�����ٸ���v=$\frac{��c}{��t}$���㣮
B��ͼ��˵��t3ʱ��C��Ũ������ƽ�������ƶ�������¶ȶ�ƽ���Ӱ����з�����
C����Qc��ƽ�ⳣ��K�ȽϺ��жϣ�
D���������D��ƽ�ⲻ�ƶ���
��� �⣺A����t1=2min��C��Ũ��Ϊ0.5mol/L����A����0.25mol/L������A���T$\frac{��c}{��t}$=$\frac{0.25mol/L}{2min}$=0.125mol/��L•min������A����
B��ͼ��˵��t3ʱ��C��Ũ������ƽ�������ƶ�����t3ʱ�����£�ƽ��������ȷ����ƶ�����������Ϊ���ȷ�Ӧ����H��0����B��ȷ��
C��t1ʱ�̴�ƽ�⣬��ʱA��B��C��Ũ�ȷֱ���0.25mol/L��0.25mol/L��0.5mol/L��K=$\frac{0.5��0.5}{0.25��0.25}$=4��t1ʱ�̺�����ϵ���ٳ���A��B��C��1mol��ЩʱA��B��C��Ũ�ȷֱ��ǣ�0.25+0.5��mol/L����0.25+0.5��mol/L����0.5+0.5��mol/L��Qc=$\frac{1��1}{0.75��0.75}$=1.8��K����ƽ�������ƶ�������Ӧռ���ƣ�����������������棩����C��ȷ��
D���������D��ƽ�ⲻ�ƶ�����ƽ��ʱA��ת���ʲ��䣬��D����
��ѡ��B��C��
���� ���⿼�黯ѧƽ��ͼ��ѧ��Ӧ���ʵļ��㡢��������Ի�ѧƽ���Ӱ�죬����Ũ������ƽ�ⳣ���Ĺ�ϵ���ж�ƽ���ƶ��ķ����Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H4��C8H8 | B�� | ����ͼ��� | C�� | 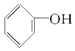 �� ��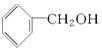 | D�� | HCHO��CH3COOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO2��N2O4Ũ����� | B�� | NO2��N2O4������֮��Ϊ2��1 | ||
| C�� | ��ϵ��ɫ���ٷ����仯 | D�� | N2O4���ٷֽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������Դ�뻷������Խ��Խ�����ǹ�ע��̼һ��ѧ��C1��ѧ����Ϊ�о����ȵ㣮����̼һ��ѧ�����Ե���̼��CO��CO2��CH4��CH3OH�Ⱥ�һ��̼ԭ�ӵ�����Ϊԭ�Ϻϳɹ�ҵ��Ʒ�Ļ�ѧ�빤�գ���1����CO2ת�����л������Чʵ��̼ѭ����CO2ת�����л�������Ӻܶ࣬�磺
������Դ�뻷������Խ��Խ�����ǹ�ע��̼һ��ѧ��C1��ѧ����Ϊ�о����ȵ㣮����̼һ��ѧ�����Ե���̼��CO��CO2��CH4��CH3OH�Ⱥ�һ��̼ԭ�ӵ�����Ϊԭ�Ϻϳɹ�ҵ��Ʒ�Ļ�ѧ�빤�գ���1����CO2ת�����л������Чʵ��̼ѭ����CO2ת�����л�������Ӻܶ࣬�磺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
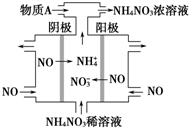 2015��3�£�ȫ�������ᡱ����ίԱ���ҹ����������������������ײߣ���ѧ���о��������������������ڴ����е������������ʱ�ܲ������������������漰�ķ�Ӧ�У�
2015��3�£�ȫ�������ᡱ����ίԱ���ҹ����������������������ײߣ���ѧ���о��������������������ڴ����е������������ʱ�ܲ������������������漰�ķ�Ӧ�У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��ѹ | B�� | ����NaF���� | C�� | ͨ��SO2���� | D�� | ����NaI���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Һ̬HCl������NaCl�������磬����HCl��NaCl�����ǵ���� | |
| B�� | SO2��ˮ��Һ�ܵ��磬����SO2�ǵ���� | |
| C�� | ���ǡ��ƾ���ˮ��Һ�������״̬ʱ�������磬�������Dz��ǵ���� | |
| D�� | ͭ��ʯī�����磬���������ǵ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com