
| H2CO3 | K${\;}_{{\;}_{{a}_{1}}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
分析 (1)向FeBr2溶液中滴加少量氯水,氯气会将亚铁离子和溴离子氧化;铁离子的检验用硫氰化钾溶液;
(2)根据电解池中阴离子的放电顺序结合电极反应式来书写;
(3)①弱酸的酸性越弱,其酸根越易结合氢离子;
②析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{\\;\\;sp}(AgCl)}{c(C{l}^{-})}$,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{O}_{4}^{-})}}$,c(Ag+)越小,则越先生成沉淀;
(4)2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,先是金属铁和氯化铁之间的反应,金属铁消耗完毕后,是金属铜和氯化铁之间的反应,根据提供数据结合金属的反应先后顺序来回答判断.
解答 解:(1)向FeBr2溶液中滴加少量氯水,氯气会将亚铁离子和溴离子氧化,产物分别是铁离子和溴单质,铁离子在溶液中呈现浅黄色,所以使溶液变黄的微粒铁离子的是铁离子,检验铁离子可以用硫氰化钾溶液,溶液会变红色,故答案为:Fe3+;取适量反应后的溶液滴加KSCN溶液变红;
(2)电解池中阴离子的放电顺序:碘离子>溴离子>氯离子,阳极首先发生反应的是碘离子,反应的电极反应式是:2I--2e-=I2;故答案为:2I--2e-=I2;
(3)①弱酸的酸性越弱,其酸根越易结合氢离子,根据表中数据,平衡常数越小,对应弱酸的酸性越弱,越易结合氢离子,所以等物质的量浓度的Na2CO3、CH3COONa、NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
②析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{\\;\\;sp}(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$=1.56×10-8,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{O}_{4}^{-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$=3×10-5,氯离子和铬酸根离子的浓度是相等的,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Cl->CrO42-,故答案为:AgCl;
(4)①根据后三组数据可以看出,多加入金属的质量和多剩余金属的质量之比是一定值,所以最后应该是金属铁完全消耗,金属铜剩余,铁离子完全反应的情况,所以粉末中铁、铜的物质的量相等,物质的量之比为1:1,故答案为:1:1;
②加入金属铁和金属铜,没有金属剩余,金属铁和氯化铁反应一定会产生亚铁离子,铜和铁离子之间反应一定会生成铜离子和亚铁离子,根据第二组数据,加入金属混合物6.6g,剩余金属是0.64g,所以加入3g金属时,铁离子还会剩余,故Ⅰ反应后的溶液中存在的金属阳离子有:Fe3+、Fe2+、Cu2+.
故答案为:Fe3+、Fe2+、Cu2+.
点评 本题综合考查学生混合物组成的计算、电解池的工作原理、沉淀溶解平衡的计算等知识,属于综合知识的考查,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯酚是一种弱酸,滴加指示剂会变色 | |
| B. | 苯酚在水溶液中能按下式电离: | |
| C. | 苯酚钠水溶液里通入CO2气体总是生成NaHCO3 | |
| D. | 苯酚有腐蚀性,溅在皮肤上可用酒精冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类都能发生水解反应 | |
| B. | 花生油在酸性或碱性条件下发生水解可制得肥皂 | |
| C. | 蛋白质溶液中,加入浓的硫酸铵溶液有沉淀析出,加水后沉淀溶解 | |
| D. | 取适量淀粉溶液于试管中,加入少量稀硫酸,加热3~5min,再冷却,滴加4~6滴氢氧化铜悬浊液,观察有无出现红色沉淀,从而判断淀粉是否发生了水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO3 | B. | CaCl2 | C. | Cl2O7 | D. | Cl2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把抗氧化剂作为食品添加剂可减缓食物变质的速率 | |
| B. | 金属钾、钠、镁着火时,不能用泡沫灭火器灭火 | |
| C. | PM 2.5粉尘中常含Pb、Cd、Cr、V、As等对人体有害的金属元素 | |
| D. | 用激光笔分别照射装有蓝墨水、淀粉溶液的玻璃杯均出现光亮通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
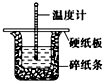 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S在过量的O2中充分燃烧,可得SO3 | |
| B. | 除去在Na2CO3固体中混有的NaHCO3的最好办法是通入过量的CO2 | |
| C. | 鉴别NaHCO3溶液与Na2CO3溶液,可用澄清的石灰水 | |
| D. | 等物质的量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com