
���� ��1����ͬ�����¸����������������ͬ����������ʵ�����ȣ�����n=$\frac{m}{M}$�����������ʵ������ٸ���M=$\frac{m}{n}$������������Է���������
��2��ͬ��ͬѹ�£��������֮�ȵ��������ʵ���֮�ȣ��ٽ��M=$\frac{m}{n}$���������Է�������֮�ȣ�
��3������n=$\frac{V}{{V}_{m}}$���������������ʵ���������n=$\frac{m}{M}$����������ƽ��Ħ������������������CO��CO2�����ʵ����ֱ�Ϊxmol��ymol�������������������ʵ����з��̼�����
��� �⣺��1���������ʵ���Ϊ$\frac{0.6g}{2g/mol}$=0.3mol����ͬ�����¸����������������ͬ����������ʵ�����ȣ��ʸ��������Է�������Ϊ$\frac{9.6}{0.3}$=32���ʴ�Ϊ��32��
��2��ͬ��ͬѹ�£�ij��������������Ϊ2��1����������ʵ���֮��Ϊ2��1������������Ϊ8��5���������Է�������֮��Ϊ$\frac{8}{2}$��$\frac{5}{1}$=4��5���ʴ�Ϊ��4��5��
��3��������������ʵ���Ϊ$\frac{10.08L}{22.4L/mol}$=0.45mol���������ƽ��Ħ������Ϊ$\frac{15g}{0.45mol}$=33.3g/mol������������CO��CO2�����ʵ����ֱ�Ϊxmol��ymol����
$\left\{\begin{array}{l}{x+y=0.45}\\{28x+44y=15}\end{array}\right.$
���x=0.3��y=0.15
��CO������Ϊ0.3mol��28g/mol=8.4g��
�ʴ�Ϊ��33.3g/mol��0.15mol��8.4g��
���� ���⿼�����ʵ����йؼ��㣬ע��Թ�ʽ�����������Ӧ�ã������ڻ���֪ʶ�Ĺ��̣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢۢ� | B�� | �٢ۢ� | C�� | �٢ڢ� | D�� | �٢ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
 ��ͼ��ʾ��ֱ��ʯӢ��������г���CO���壬��˷��ò���������Ni���ۣ���һ�������£�Ni������CO��g���������·�Ӧ��Ni��s��+4CO��g��$?_{453��473K}^{323��353K}$Ni��CO��4��g��
��ͼ��ʾ��ֱ��ʯӢ��������г���CO���壬��˷��ò���������Ni���ۣ���һ�������£�Ni������CO��g���������·�Ӧ��Ni��s��+4CO��g��$?_{453��473K}^{323��353K}$Ni��CO��4��g��| A�� | ��ʯӢ���Ҷ���Ҫ������Ni��CO��4��g�� | |
| B�� | ��ʯӢ���Ҷ���Ҫ�����Ǵ�Ni��s����CO��g�� | |
| C�� | ��ʯӢ�������Ҫ�����Ǵ�Ni��s����CO��g�� | |
| D�� | �������̿��Կ���CO��g����Ni��s����ʯӢ�����ת�Ƶ��Ҷˣ��Ӷ��ﵽ�ᴿĿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH3 | B�� | SO2 | C�� | CH4 | D�� | H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C3H6 | B�� | CH2O2 | C�� | C2H6O | D�� | C3H6O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��ʾˮ�����Թ�����һö��������������۲죺
��ͼ��ʾˮ�����Թ�����һö��������������۲죺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
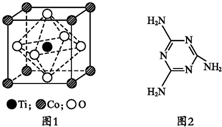 MnO2�Ǽ��̵�ز���������ͨ����������֮һ���ڻ��Բ���MnO2�м���CoTiO3�����壬��������������ʣ��Ż����̵�ص����ܣ�
MnO2�Ǽ��̵�ز���������ͨ����������֮һ���ڻ��Բ���MnO2�м���CoTiO3�����壬��������������ʣ��Ż����̵�ص����ܣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com