
利用下列实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤作用的活性物质。
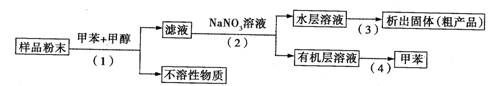 下列说法错误的是( )
下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(3)需要用到蒸发皿
C.步骤(4)是利用物质的沸点差异进行分离的
D.活性物质易溶于有机溶剂,难溶于水
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
对于在一密闭容器中进行的下列反应:C(s)+ O2(g) CO2(g)下列说法中错误的是
CO2(g)下列说法中错误的是
A.将木炭粉碎成粉末状可以加快化学反应速率
B.升高温度可以加快化学反应速率
C.增加压强不能加快化学反应速率
D.增加木炭的量可以加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的说法正确的是( )
A.生铁与钢的区别在于生铁含碳杂质,而钢不含
B.铜在自然界中的含量高,所以铜是人类最早使用的金属
C.黑色金属材料包括铁、铬、锰及其化合物
D.金属一般都具有导电性、导热性、延展性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
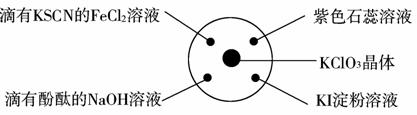
| 选项 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
| B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
| C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
| D | KI淀粉溶液变蓝色 | Cl2具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
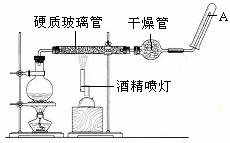
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)实验前必须对整套装置进行气密性检查,操作方法是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)干燥管中盛装是的物质是 ,作用是 。
( 5)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理、浸取、净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
已知:锌元素与铝元素相似,具有两性。
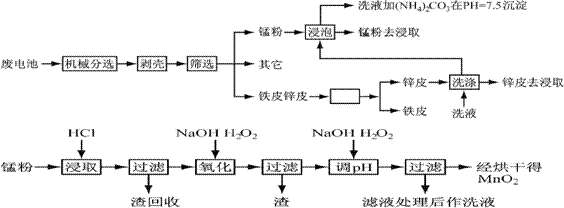
1、市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为 ;
电极总反应方程为 ;
2、在预处理中,分离铁皮和锌皮的方法是 ,洗液加(NH4)2CO3在pH=7.5沉淀出一种碱式盐,该物质的化学式为 。
3、二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式 ;盐酸溶解后回收的渣是 ;
4、已知第二次加H2O2后调节pH≈9的目的为将Mn2+转化为MnO2,则第一次加H2O2后调节pH≈5,目的是 ;
5、实验室中用高锰酸钾溶液检验Mn2+时,产生黑色沉淀,该反应的离子方程式为
;
硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀有气体的相对分子质量为Mr,N表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的原子数为X.则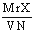 表示的是 ( )
表示的是 ( )
A.以g为单位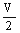 L该气体的质量 B.以g为单位1L该气体的质量
L该气体的质量 B.以g为单位1L该气体的质量
C.1L该气体中所含的分子数 D.以L为单位1mol该气体的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液使SO42-恰好沉淀完全,请写出发生反应的离子方程式:______ 。
(2)在一定条件下,RO4n--和I-发生反应的离子方程式如下:
RO4n- +8I- +8H+=== R- +4I2 +4H2O中R元素的化合价为 .
(3)常温常压下,将CO与CH4的混合气体10L与25L氧气混合,点燃后充分反应,则剩余气体为24L(恢复为常温常压),则原来混合气体中CO与CH4的体积比为 。
(4)以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n(SO2)= mol(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
敞口放置的澄清石灰水,久置空气中石灰水会变________________,说明空气中含有少量的____________________,该反应的化学方程式是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com