
已知反应:2CH3COCH3(l)  CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是( )
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是( )
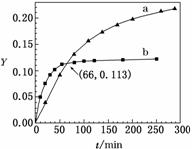
A.b代表0 ℃下CH3COCH3的Y-t曲线
B.反应进行到20 min末,CH3COCH3的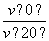 >1
>1
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的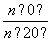 =1
=1
科目:高中化学 来源: 题型:
配制一定物质的量浓度的溶液时,下列操作中一定能造成所配溶液的浓度偏高的是
A.定容后振荡容量瓶,发现液面略低于刻度线,又用胶头滴管加水至刻度线
B.配制时洗涤烧杯和玻璃棒各一次,将洗涤液用玻璃棒引流转移至容量瓶
C.配制一定物质的量浓度的稀硫酸时,将浓硫酸在烧杯中加水稀释后,未进行冷却就立即转移到容量瓶中定容
D.量取浓硫酸时俯视量筒的刻度线,定容时仰视容量瓶的刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
B.取a克混合物与足量稀硫酸充分反应,逸出气体未经干燥用碱石灰吸收,增重b克
C.取a克混合物充分加热至恒重,减重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等但不等于0
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D.化学反应的限度不可以通过改变条件而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体 ②铁在潮湿的空气中容易生绣 ③实验室可用排饱和食盐水的方法收集氯气 ④常温下,将1 mL pH=3的醋 酸加水稀释至100 mL,测得其pH<5 ⑤钠与氯化钾共融制备钾:
酸加水稀释至100 mL,测得其pH<5 ⑤钠与氯化钾共融制备钾:
Na(l)+KCl(l)  K(g)+NaCl(l) ⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
K(g)+NaCl(l) ⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
A.①②③ B.②⑥
C.①③④⑤ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)
该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,则10 min内CO2的平均反应速率为0.015 mol/(L·min),10 min后生成了单质铁________g。
(2)可用上述反应中某种物理量来说明该反应已达到平衡状态的是______________。
A.CO的生成速率与CO2的生成速率相等
B.CO生成速率与CO2消耗速率相等
C.CO的质量不变
D.体系的压强不再发生变化
E.气体密度不再变化
(3)写出氢氧化铝在水中发生酸式电离的电离方程式;
________________________________________________________________________。
欲使上述体系中H+浓度增大,可加入的物质是________。
A.NaOH B.HCl
C.NH3 D.NaHSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式,不正确的是
A.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+===I2+O2↑+2H2O
B.自然 界中正常的雨水呈酸性:
界中正常的雨水呈酸性:
H2O+CO2H2CO3H++HCO
C.将1 mol·L-1NaAlO2溶液和1 mol·L-1的H2SO4溶液等体积均匀混合:
3AlO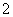 +6H+===2Al(OH)3↓+Al3+
+6H+===2Al(OH)3↓+Al3+
D.向明矾溶液中滴加氢氧化钡溶液至SO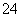 完全沉淀:Al3++2SO
完全沉淀:Al3++2SO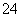 +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO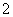 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
ΔH=-196.6 kJ/mol
2NO(g)+O 2(g)
2(g)  2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH=________ kJ/mol。
SO3(g)+NO(g)的ΔH=________ kJ/mol。
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
 (2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是_____________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com