
【题目】下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
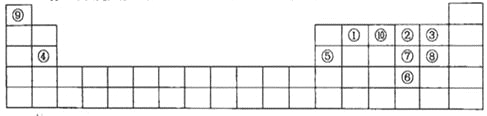
(1)在这10种元素中,非金属性最强的是___________(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为_________,元素②与⑨形成的18e-化合物的电子式____________________;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有___________________________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:____>____(用化学式表示)。
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式______________________。
【答案】(1)③;
(2)H—O—Cl;![]() ;
;
(3)离子键和共价键
(4)HCl> H2S。(5)Al2O3+2OH-=2AlO2-+H2O
【解析】试题分析:根据元素周期表的结构可判断①为碳,②为氧,③为氟,④为镁,⑤为铝,⑥为硒,为⑦硫,⑧为氯,⑨为氢,⑩为氮。
(1)在同一周期的元素中,元素的原子序数越大,元素的非金属性越强,在不同周期的元素中,元素的原子核外的电子层数越少,元素的非金属性越强。因此在这些元素中非金属性最强的是③F元素。
(2)元素O、Cl、H三元素以原子个数比1:1:1形成的化合物HClO的结构式为H—O—Cl。元素O、H形成的18e-化合物H2O2的电子式为![]() 。
。
(3)H、N、O三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3。该化合物为离子化合物,其中含有的化学键类型有离子键、共价键。
(4)S、Cl是同一周期的元素。元素的元素半径越小,元素得到电子的能力就越强,元素的非金属性就越强。元素结合H形成的氢化物的稳定性就越强。所以稳定性HCl>H2S。
(5)元素⑤是Al,其氧化物Al2O3是两性氧化物,既能与强酸反应也能与强碱发生反应,生成盐和水。Al2O3与NaOH溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O。


科目:高中化学 来源: 题型:
【题目】(1)氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2)与![]() 等电子体的分子 ,根据等电子体原理在
等电子体的分子 ,根据等电子体原理在![]() 中氮原子轨道杂化类型是__________;
中氮原子轨道杂化类型是__________;![]() 与N2是等电子体,1 mol
与N2是等电子体,1 mol![]() 中含有的π键数目为__________个。
中含有的π键数目为__________个。
(3)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)O3分子是否为极性分子?__________。(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对教材中的铁与高温水蒸气反应的实验装置图做了如图所示的优化。通过观察硬质玻璃管Ⅱ和干燥管Ⅱ中的现象证明铁与水蒸气发生了反应,用试管收集产生的经干燥的气体,并靠近火焰点火,观察现象。
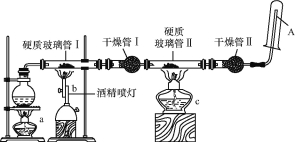
请回答下列问题:
(1)在圆底烧瓶内放入少许碎瓷片,其作用是 。
(2)写出铁与高温水蒸气反应的化学方程式: 。
(3)实验时将铁粉与石棉绒混合放在硬质玻璃管Ⅰ中,其原因可能是 (填“A”“B”或“C”)。
A.石棉绒的作用是催化剂
B.石棉绒的作用是使铁粉受热均匀
C.石棉绒的作用是作铁粉的载体以及防止铁粉被吹入导管引起堵塞
(4)酒精灯a和酒精喷灯点燃的顺序是 ,原因是 。
(5) 能证明铁与水蒸气反应的现象是 。
(6) 试管中收集的气体是氢气,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
① Na2O2和H2O ② Al和NaOH溶液 ③ MnO2和浓盐酸共热 ④ 铜片和浓硫酸共热
A. 只有①② B. 只有①③ C. 只有②③ D. 只有③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟七号”所用动力燃料之一为氢化锂“三兄弟”——LiH、LiD、LiT。有关LiH、LiD、LiT叙述正确的是( )
A. 质子数之比为1∶2∶3
B. 中子数之比为1∶1∶1
C. 摩尔质量之比为8∶9∶10
D. 化学性质不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高三一年的化学复习,学生要抓住两方面,一方面是教材,另一方面是历年的高考真题。每年的高考题,在教材中几乎都能找到影子,所以同学一定要紧紧抓住教材,根据《必修一》第三章和第四章的内容回答下列问题:
(1)实验3-1是取用钠单质的实验,用品有小刀, 、 、培养皿。
(2)金属铝及其化合物在日常的生产生活中,用途很广泛,氧化铝的用途 (举一例)。 氢氧化铝的用途 (举一例)。
(3)印刷铜箔电路板常用FeCl3溶液作为腐蚀液,写出反应的离子方程式 。
(4)漂白粉或漂粉精失效的原理为(请用化学方程式表示): 、 。
(5)石灰法是目前应用最广泛的工业废气脱硫法,过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,其产物可用作建筑材料。有关的反应化学方程式为:CaCO3![]() CaO + CO2 、 。
CaO + CO2 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
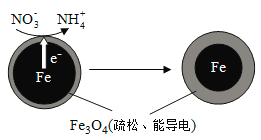
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
pH =4.5(其他条件相同)

(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关表述正确的是( )
A.离子晶体一定含金属阳离子
B.非金属元素形成的单质一定是分子晶体
C.在共价化合物分子中各原子都形成8电子结构
D.共价键能存在于共价化合物中,也能存在于离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种有机物的有关信息:
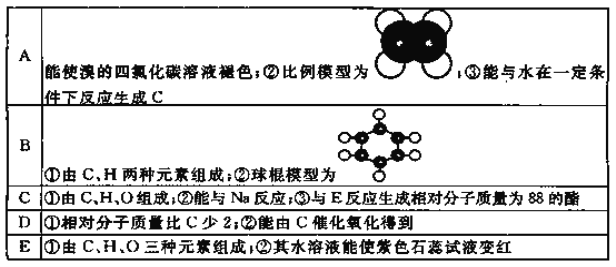
回答下列问题:
(1) A~E中,属于烃的是_____________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为___________________。
(3)有机物B具有的性质是_______________________(填序号)。
①无色无味的液体; ②有毒; ③不溶于水; ④密度比水大; ⑤能使酸性KMnO4溶液和溴水褪色
(4)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是:____________________(用化学方程式说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com