
 反应A(g)+B(g)?C(g)+D(g)△H过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)△H过程中的能量变化如图所示,回答下列问题.分析 由反应过程中的能量变化图可知,反应物的总能量高于生成物的总能量,为放热反应,升高温度,平衡逆向移动,加入催化剂,可降低反应的活化能,但反应热不变,以此解答该题.
解答 解:(1)由反应过程中的能量变化图可知,反应物的总能量高于生成物的总能量,故反应为放热反应,
故答案为:放热;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,A的转化率减小,
故答案为:减小;
(3)加入催化剂能降低反应物质的活化能,则E1和E2都减小,但反应物、生成物的总能量不变,则反应热不变,故答案为:减小;减小;不变.
点评 本题考查化学反应与能量的变化,为高频考点,侧重考查学生的分析能力,题目难度不大,注意根据图象判断反应物总能量与生成物总能量的关系,把握催化剂对反应的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 垃圾焚烧处理可使资源再利用,能减少污染 | |
| C. | 开发太阳能、风能和氢能等,有利于节约资源、保护环境 | |
| D. | 农作物秸秆收割后可发酵制造沼气和农家肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用氨水除去试管内壁上的银镜 | |
| B. | 乙烯可以用作生产食品包装材料的原料 | |
| C. | 食用白糖的主要成分是蔗糖 | |
| D. | 乙酸与甲酸甲酯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色,发生了氧化反应 | |
| B. | 苯在一定条件下能与浓硝酸反应得到硝基苯,发生了取代反应 | |
| C. | 邻二氯苯不存在同分异构体说明了苯不存在单双键交替的结构 | |
| D. | 1mol甲烷和1mol氯气在光照条件下发生反应,产物只有CH3Cl和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H互为同位素 | B. | 金刚石和石墨互为同素异形体 | ||
| C. |  和 和  互为同分异构体 互为同分异构体 | D. | CH4和C2H6互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O
+3H2O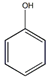 +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发氟氯代烷制冷剂,有利于保护臭氧层 | |
| B. | 绿色食品就是不使用农药,不含任何化学物质的食品 | |
| C. | 推广使用煤液化技术,可减少二氧化碳温室气体的排放 | |
| D. | 使用可降解的无毒聚乳酸塑料代替乙烯作食品包装袋,可减少白色污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com