
| A. | 温度过高对合成氨不利 | |
| B. | 合成氨在高压下进行是有利的 | |
| C. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| D. | 增加N2的浓度可提高平衡混合物中NH3的含量 |
分析 勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒夏特列原理适用的对象应存在可逆过程,若与可逆过程无关,与平衡移动无关,则不能用勒夏特列原理解释.
解答 解:A.该反应的正逆反应是放热反应,温度越高,平衡逆向移动,对合成氨不利,所以可以用平衡移动原理解释,故A不选;
B.该反应前后气体的物质的量之和减小,增大压强,平衡正向移动,所以合成氨在高压下进行是有利的,可以用平衡移动原理解释,故B不选;
C.催化剂能增大化学反应速率,但不引起平衡移动,所以不能用平衡移动原理解释,故C选;
D.增加氮气浓度,平衡正向移动,所以可以提高平衡混合物中氨气含量,所以可以用平衡移动原理解释,故D不选;
故选C.
点评 本题考查化学平衡移动原理,为高频考点,只有能引起平衡移动的因素才能用勒夏特里原理解释,注意:催化剂只改变化学反应速率不影响平衡移动.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(Na+)>c(H+)>c(HC2O4- )>c(C2O42-)>c(OH-) | |
| B. | V(NaOH)=5 mL时,c(Na+)═c(C2O42-)+c(HC2O4- )+c(H2C2O4) | |
| C. | V(NaOH)=10 mL时,c(Na+)═c(HC2O4-)+c(C2O42-) | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
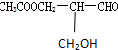 有光学活性,此分子中手性碳原子数目( )
有光学活性,此分子中手性碳原子数目( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中碳、氢、氧原子个数比为1:2:3 | |
| B. | 该有机物分子中碳、氢原子个数比为1:2 | |
| C. | 该有机物中肯定含氧 | |
| D. | 可以判断该有机物中是否含氧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com