
分析 发生反应:Fe+2HCl=FeCl2+H2↑,生成氢气为$\frac{3.36L}{22.4L/mol}$=0.15mol,根据方程式计算消耗Fe、HCl的物质的量,生成FeCl2的物质的量.
(1)根据m=nM计算Fe的质量;
(2)根据V=$\frac{n}{c}$计算消耗盐酸的体积;
(3)根据c=$\frac{n}{V}$计算所得溶液中Fe2+的物质的量浓度.
解答 解:生成氢气为$\frac{3.36L}{22.4L/mol}$=0.15mol,则:
Fe+2 HCl=FeCl2+H2↑
1 2 1 1
0.15mol 0.3mol 0.15mol 0.15mol
(1)反应中消耗铁粉的质量为0.15mol×56g/mol=8.4g,
答:消耗Fe的质量为8.4g;
(2)所取盐酸的体积为$\frac{0.3mol}{0.5mol/L}$=0.6L,
答:消耗盐酸体积为0.6L;
(3)假设反应前后溶液体积不变,则所得溶液中Fe2+的物质的量浓度为$\frac{0.15mol}{0.6L}$=0.25mol/L,
答:所得溶液中Fe2+的物质的量浓度为0.25mol/L.
点评 本题考查化学方程式计算,比较基础,有利于基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
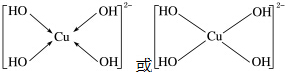 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c mol/L | B. | 3c mol/L | C. | $\frac{3c{V}_{1}}{{V}_{2}}$mol/L | D. | $\frac{c{V}_{1}}{{V}_{2}}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硫酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化铜溶于盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
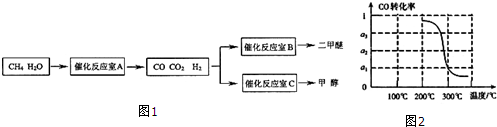
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
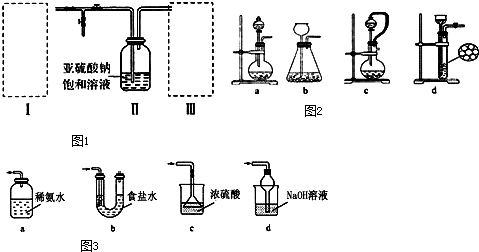
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com