
【题目】下列物质中所含分子的物质的量最多的是( )
A.4℃时2.7mL水B.含6.02×1023个氧原子的一氧化碳
C.6.02×1022个氯化氢分子D.4.9g磷酸
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义.
(1)用CO可以合成甲醇.已知:
①CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
③H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
则CO(g)+2H2(g)CH3OH(g)△H=kJmol﹣1
下列措施中能够增大上述合成甲醇反应的反应速率的是(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(2)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2 , 在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图1所示. 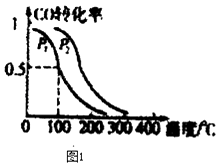
①p1p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=;
③100℃时,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2号 CH3OH各0.5amol,则平衡(填“向右”、“向左”或“不”移动)
④在其它条件不变的情况下,再增加a mol CO和2a molH2 , 达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”).
(3)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示.在T1﹣T2及T4﹣T5两个温度区间,容器内甲醇的体积分数的变化趋势如图2所示,其原因是 . 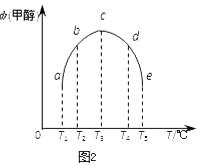
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种重要的液态火箭燃料,具有强还原性,工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4·H2O)、Na2CO3等物质。
(1)下列物质的摩尔质量与肼的摩尔质量相同的是______(填字母)。
A.氧气 B.硫化氢 C.硅化氢 D.氟气
(2)上述生成水合肼的反应中尿素作_____(填“氧化剂”或“还原剂”),上述反应的化学方程式为_________________。
(3)发射“神舟飞船的长征火箭用肼作燃料,以二氧化氮作氧化剂,两者反应会生成氮气和水。该反应中每生成6.72L(标准状况)N2,转移电子的物质的量为________。
(4)肼燃烧易产生NO,可用漂白粉溶液脱除NO。为提高NO的脱除率,在其他条件相同时,向漂白粉溶液中分别加入三种不同添加剂,测得其对NO脱除率的影响如图所示。由图可知,KMnO4、H2O2、NaClO2的氧化性由弱到强的顺序是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。
(1)写出SOCl2吸收水蒸气的化学方程式:_________________
(2)甲同学设计如图所示装置,用ZnCl2·xH2O晶体制取无水ZnCl2、回收SOCl2并验证生成物中含有SO2(夹持及加热装置略)。

①装置的连接顺序为A→B→______→_____→_____。(填字母)
②冷凝管的作用是____________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤、冼绦、干燥,称得固体为bg。若![]() =___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
=___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验中会发生氧化还原反应。请你设计并简述实验方案判断丙同学的观点:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中混有的少量杂质,所选用的试剂及操作方法正确的是
物质 | 杂质(少量) | 试剂和操作方法 | |
A | O2 | H2O(蒸汽) | 通过浓H2SO4 |
B | CO2 | CO | 点燃 |
C | KCl固体 | KClO3 | 加入MnO2并加热 |
D | KNO3溶液 | Ba(NO3)2溶液 | 加入适量的Na2SO4溶液,过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)新制氯水在阳光照射下缓慢产生的无色气体为_______(填化学式)。
(2)氢氟酸若用玻璃试剂瓶盛装,发生的主要反应的化学方程式为_______。
(3)实验室常用Al2(SO4)3和NH3·H2O制备Al(OH)3其反应的离子方程式为_______。
(4)用玻璃棒蘸浓硫酸滴在火柴梗上,火柴梗变黑,浓硫酸表现出来的性质为_______。
(5)维生素C能将人体摄取的Fe3+转变为Fe2+,说明维生素C具有_______(选填“氧化性”或“还原性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了如图所示的实验装置。
已知:① 氯气和碱反应放出热量。
②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O

请回答下列问题:
(1)甲装置中仪器a的名称是_______,该装置中发生反应的离子方程式为_______。
(2)装置丁中NaOH的作用是_______。
(3)①制取漂白粉的化学方程式是_______。
②小组制得的漂白粉中n(CaCl2 )远大于n[ Ca(ClO)2],主要原因可能是_______。
(4)为提高Ca(ClO)2的含量,可采取的措施是_______ (任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请回答下列问题:
(1)单质铁属于晶体.黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中一个反应为3FeS2+8O2 ![]() 6SO2+Fe3O4 , 氧化产物为 , 若有3molFeS2参加反应,转移mol电子.
6SO2+Fe3O4 , 氧化产物为 , 若有3molFeS2参加反应,转移mol电子.
(2)铝的价电子排布式为 , 明矾用作净水剂,其原理为(用离子方程式表示).
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,Cu与氨水、双氧水反应的离子方程式;
(4)铁红是一种红色颜料,其成分是Fe2O3 , 将一定量的铁红溶于160mL5molL﹣1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+ , 参加反应的铁粉的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯可用作合成纤维、合成橡胶、合成塑料的原料。回答下列问题:
(1)实验室用乙醇和五氧化二磷制取乙烯的过程如下:
P2O5+3H2O=2H3PO4
H3PO4+C2H5OH→C2H5OPO(OH)2(磷酸单乙醋)+H2O;
170~200 ℃时,C2H5OPO(OH)2会分解生成乙烯和磷酸。
C2H5OPO(OH)2分解反应的化学方程式为___________________。
(2)向2 L的恒容密闭容器中充入0.1mol C2H6和0.1 molCO2,发生的反应为
C2H6 (g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。
C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。

①在相应温度下,A点的反应速率v(正)________(填“>”“<”或“=”)v(逆)。
②若不考虑副反应的发生,为提高C2H6的平衡转化率,除了将生成物及时从体系中分离出来外,还可采取的措施有________________ (任写一种)。
③720℃时,上述反应的平衡常数K=______________。
(3)用CrO3作催化剂,CO2重整C2H6制乙烯的反应过程如下:
C2H6(g)![]() C2H4(g)+H2(g) △H1 ;
C2H4(g)+H2(g) △H1 ;
3H2(g)+2CrO3(s)=3H2O(g)+Cr2O3(s) △H2 ;
Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) △H3。
①反应:C2H6(g)+CO2(g)![]() C2H4(g)+ CO2(g) +H2O(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。
C2H4(g)+ CO2(g) +H2O(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。
②已知部分化学键的键能数据如下表所示,则△H1=__________kJ·mol-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJ mol-1 | 348 | 615 | 413 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com