
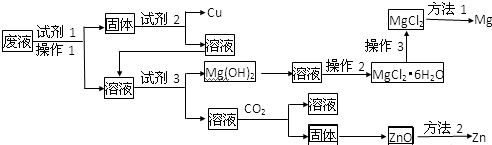
分析 废液中含有Cu2+、Mg2+、Zn2+等离子,加入试剂1得到固体,且固体中加入试剂2得到Cu,故固体中含有Cu,那么试剂1是能还原铜离子的物质,结合题目得知,为锌粉,试剂2是可以溶解过量锌粉,且不能溶解Cu的物质,可以是稀硫酸或稀盐酸,由此流程可知最终得到盐酸盐,为不引入新杂质,故选择稀盐酸,操作1后的溶液中含有Mg2+和Zn2+;加入试剂3生成氢氧化镁沉淀,故试剂3为氢氧化钠,依据“Zn(OH)2的性质与Al(OH)3相似”得知过量的氢氧化钠与锌离子生成溶液,此溶液中通入二氧化碳气体生成氢氧化锌,氢氧化锌加热分解生成ZnO,据此解答各小题即可.
解答 解:(废液中含有Cu2+、Mg2+、Zn2+等离子,加入试剂1得到固体,且固体中加入试剂2得到Cu,故固体中含有Cu,那么试剂1是能还原铜离子的物质,结合题目得知,为锌粉,试剂2是可以溶解过量锌粉,且不能溶解Cu的物质,可以是稀硫酸或稀盐酸,为不引入新杂质,故选择稀盐酸,操作1后的溶液中含有Mg2+和Zn2+;加入试剂3生成氢氧化镁沉淀,故试剂3为氢氧化钠,依据“Zn(OH)2的性质与Al(OH)3相似”得知过量的氢氧化钠与锌离子生成溶液,此溶液中通入二氧化碳气体生成氢氧化锌,氢氧化锌加热分解生成ZnO,
(1)由分析可知:试剂1、试剂2、试剂3分别可以是②、④⑤、⑦,故答案为:②;④⑤;⑦;
(2)操作2是从溶液中得到固体,那么次操作是蒸发浓缩、冷却结晶、过滤,故答案为:蒸发浓缩;冷却结晶;过滤;
(3)由于氯化镁为强酸弱碱盐,镁离子容易水解,故应在HCl气流中加热以防止镁离子水解,故答案为:在HCl气流中加热;
(4)偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,据此得出氢氧化锌与过量的氢氧化钠反应生成ZnO22-(由于Zn为+2价,据此得出此离子),此离子与二氧化碳反应生成氢氧化锌沉淀,故离子反应方程式为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-,故答案为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-;
(5)试剂7为氢氧化钠溶液能分离出Mg(OH)2的原理是氢氧化镁不溶于过滤氢氧化钠溶液,氢氧化锌能溶于过滤氢氧化钠溶液,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,Zn2++4OH-=ZnO22-+2H2O,
故答案为:Mg2++2OH-=Mg(OH)2↓、Zn2++4OH-=ZnO22-+2H2O;
(6)活泼金属采用电解法冶炼,较活泼金属采用热还原法冶炼,由于Mg很活泼,故采用电解法,Z你n较活泼,采用还原剂法,故答案为:电解法;还原剂法.
点评 本题主要考查的是无机流程中的物质的分离和提纯,涉及化学试剂的选取、铝的两性类比考查、活泼金属的冶炼方法等,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量 | |
| B. | 436kJ/mol是指断开1molH2 中的H-H键需要放出436kJ的能量 | |
| C. | 431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量 | |
| D. | 氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①、③的操作都是过滤 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是乙醇 | |
| D. | 步骤④的操作是精馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改燃煤为燃气,可以减少废气中SO2等有害物质的排放量天气的一种措施 | |
| B. | 84 消毒液的有效成分是 NaClO | |
| C. | 含有食品添加剂的食物对人体健康不一定有益 | |
| D. | 金属防护中:牺牲阳极的阴极保护法利用的是电解原理,外加电流的阴极保护法利用的 是原电池原理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com