
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。

①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________ mol;用平衡移动原理解释阴极区pH增大的原因:________________________________________________________________________
________________________________________________________________________。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为______________________________________________
________________________________________________________________________。
若以该电池为电源,用石墨作电极电解100 mL含有以下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________ mol。
答案 (1)①Cl--5e-+2H2O===ClO2↑+4H+
②0.01 在阴极发生2H++2e-===H2↑,H+浓度减小,使H2O??H++OH-的平衡向右移动,OH-浓度增大,pH增大
(2)O2+4e-===2O2- 0.1
解析 (1)①阳极失去电子发生氧化反应。②水电离产生的H+在阴极上放电产生氢气,转移电子的物质的量n(e-)=2n(H2)=2×(0.112 L÷22.4 L·mol-1)=0.01 mol,则在内电路中移动的电荷为0.01 mol,每个Na+带一个单位的正电荷,则通过的Na+为0.01 mol。(2)电池工作时,正极上O2得电子发生还原反应生成O2-。结合离子浓度可知电解过程可分为三个阶段:先是电解CuCl2、然后电解HCl、最后电解水,由此可见阴极首先析出0.1 mol Cu(同时阳极析出0.1 mol Cl2),然后析出氢气;阳极上先是析出 0.2 mol Cl2(此时阴极已析出0.1 mol H2),再析出氧气,设阳极析出 x mol O2时两极析出气体体积相等,由题意可得:0.2+x=0.1+2x,解得x=0.1。(3)②利用方程式可知Co3+被还原,甲醇中碳元素被氧化,依据方程式可知生成1 mol CO2时,有6 mol Co3+被还原为Co2+,可知转移6 mol电子,由此可推知当产生标况下2.24 L CO2(0.1 mol)时,转移电子0.6 mol。


科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)所有金属纯度越大,越不易被腐蚀( )
(2)纯银器表面变黑和钢铁表面生锈腐蚀原理一样( )
(3)干燥环境下金属不被腐蚀( )
(4)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物( )
(5)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+( )
(6)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用( )
(7)外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池。二者均能有效地保护金属不容易被腐蚀( )
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是( )
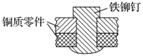
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e===Fe2+
D.发生化学腐蚀:Fe+Cu2+===Cu+Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾。从开始通电时,收集B和C逸出的气体。1 min 后测得B口的气体体积为C口处的一半,下列说法不正确的是( )
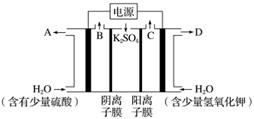
A.电源左侧为负极
B.电解槽左侧的电极反应方程式为2H2O-4e-===O2+4H+
C.D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大
D.在标准状况下,若1 min后从C口处收集到的气体比B口处收集到的气体多2.24 L,则有0.1NA个SO 通过阴离子膜
通过阴离子膜
查看答案和解析>>
科目:高中化学 来源: 题型:
通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下面列举了一些化学键的键能数据,供计算使用。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)===Si(s)+4HCl(g),该反应的反应热ΔH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列热化学方程式书写是否正确,正确的划“√”,错误的划“×”(注:焓变数据均正确)
(1)CaCO3(s)===CaO+CO2(g) ΔH=+177.7 kJ( )
(2)C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
(3)C(s)+ O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1( )
(4)CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1( )
(5)2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1( )
(6)500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热
19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1( )
2NH3(g) ΔH=-38.6 kJ·mol-1( )
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题是现代社会发展的三大基本问题之一,能源家族中:①煤炭、②核能、③石油、④天然气、⑤水能、⑥风能、⑦地热能等,属于不可再生的是________(填序号,下同);属于新能源的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com