
向50 g浓度为c mol·L-1、密度为ρ g·cm-3的硫酸溶液中加入一定量的水稀释至浓度为0.5c mol·L-1,则加入水的体积应 ( )
A.小于50 mL B.等于50 mL
C.大于50 mL D.等于50/ρ mL
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 CHCl3+HCl使CCl4转
CHCl3+HCl使CCl4转 化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl
化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl 和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度℃ | 初始CCl4浓度(mol/L) | 初始H2浓度(mol/L) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为________________,在110℃时平衡常数为____________。
②实验1中,CCl4的转化率A__________50%(填“大于”、“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为__________。
④实验3中,B的值________(选填序号)。
A.等于50% B.大于50%
C.小于50% D.从本题资料无法判断
(2)120℃时,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol/L和4 mol/L的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。

①在图中的四条线中,表示H2起始浓度为2 mol/L的实验消耗CCl4的百分率变化曲线是________(选填序号)。
②根据上图曲线,氢气的起始浓度为________ mol/L时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量。你判断的依据是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.25 ℃时,1 L 0.1 mol·L-1的CH3COOH溶液中,含氢离子数约为0.1NA
B.标准状况下,22.4 L CHCl3中含氯原子数为3NA
C.1mol Na2O2晶体中所含离子数为3NA
D.0.5 mol NaCl晶体中含0.5NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,正确的是 ( )

A.实验室用①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是电解池,锌电极为正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
下列判断不正确的是 ( )
A.实验①反应后的溶液中:c(K+) > c(A-) > c(OH-) > c(H+)
B.实验①反应后的溶液中:c(OH-) = c(K+) — c(A-) =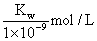
C.实验②反应后的溶液中:c(A-) + c(HA) > 0.1mol/L
D.实验②反应后的溶液中:c(K+) = c(A-) > c(OH-) = c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列给定条件的溶液中,一定大量共存的离子组是
A.1.0 mol·L-1的Na2CO3溶液:
Fe2+、H+、Cl-、SO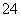
B.甲基橙呈红色的溶液:Na+、K+、SiO 、NO
、NO
C.由水电离出的c(H+)=2.0×10-10的溶液中:
Ba2+、K+、Cl-、HCO
D.含大量Al3+的溶液中:Cu2+、Na+、SO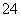 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
给下列有机物命名:
 ①麻黄素中含氧官能团的名称是________,属于______类(填“醇”或“酚”)。
①麻黄素中含氧官能团的名称是________,属于______类(填“醇”或“酚”)。
②下列各物质:
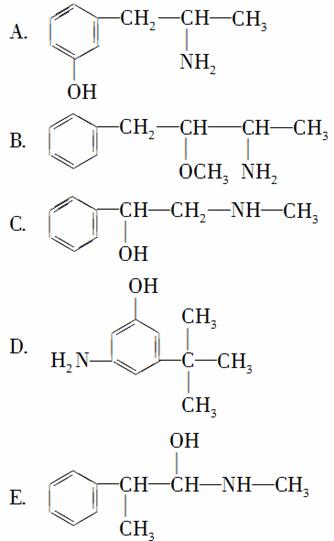
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com