
| A | B | C | D |
| 除去Cl2中的HCl | 制取少量纯净的CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
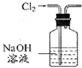 | 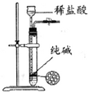 | 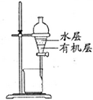 | 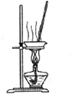 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者均与NaOH反应;
B.纯碱为粉末固体,关闭止水夹不能使固、液分离,且盐酸易挥发;
C.CCl4萃取碘水后,水的密度小在上层;
D.蒸干时氯化铵易分解.
解答 解:A.二者均与NaOH反应,则不能除杂,应选饱和食盐水除杂,故A错误;
B.纯碱为粉末固体,关闭止水夹不能使固、液分离,且盐酸易挥发,则不能利用图中装置制取少量纯净的CO2气体,故B错误;
C.CCl4萃取碘水后,水的密度小在上层,则图中分液装置及已分层的有机层和水层位置合理,故C正确;
D.蒸干时氯化铵易分解,则不能蒸干,应利用冷却结晶法制备NH4Cl晶体,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、气体的制备等,把握物质的性质、反应原理、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A,C,D都是有机物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A,C,D都是有机物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
若20 g密度为ρ g·cm-3的Ca(NO3)2(相对分子质量为164)溶液中含有1 g Ca(NO3)2,则溶液中NO 的物质的量浓度为( )
的物质的量浓度为( )
A.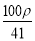 mol·L-1 B.
mol·L-1 B.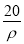 mol·L-1 C.
mol·L-1 C.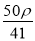 mol·L-1 D.
mol·L-1 D.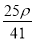 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
利用实验器材(规格和数量不限)不能完成相应实验的一项是( )
选项 | 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、蒸发皿、酒精灯 | CuSO4溶液的浓缩结晶 |
B | 烧杯、玻璃棒、胶头滴管、滤纸、漏斗 | 用盐酸除去BaSO4中少量BaCO3 |
C | 烧杯、玻璃棒、托盘天平、容量瓶 | 用固体NaCl配制0.5 mol·L-1的溶液 |
D | 烧杯、分液漏斗 | 用CCl4萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述反应可知氧化性HNO3>Fe3+>稀硫酸 | |
| C. | 上述过程中,会产生一种无色、难溶于水的气体 | |
| D. | 若通入的SO2完全反应,则通入的SO2和逸出的气体物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
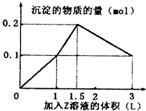 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )| A. | 偏铝酸钠、氢氧化钡、硫酸 | B. | 偏铝酸钠、氯化钡、硫酸 | ||
| C. | 氯化铝、氯化镁、氢氧化钠 | D. | 氯化铝、氯化铁、氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜及其化台物在工业、农业、科技和日常生活中有广泛应用.
铜及其化台物在工业、农业、科技和日常生活中有广泛应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com