
分析 浓盐酸和二氧化锰在加热条件下生成氯气,但稀盐酸和二氧化锰在加热条件下不反应,据此分析解答.
解答 解:浓盐酸和二氧化锰在加热条件下生成氯气,但稀盐酸和二氧化锰在加热条件下不反应,所以①中浓盐酸在反应中浓度达到一定程度时就不和二氧化锰反应了,导致生成的氯气物质的量小于1mol,②中浓盐酸足量,当二氧化锰完全反应时生成1mol氯气,所以二者产生的氯气不一样多,
答:二者产生的氯气不一样多;因为浓盐酸和二氧化锰反应生成氯气而稀盐酸和二氧化锰不反应,当①中浓盐酸在反应中浓度达到一定程度时就不和二氧化锰反应了,②中浓盐酸足量,所以前者生成的氯气小于后者.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析判断能力,明确浓盐酸、稀盐酸性质差异性是解本题关键,注意反应①中盐酸浓度的变化,题目难度不大.


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{15}^{52}$P的原子核中含有15个中子 | |
| B. | ${\;}_{15}^{52}$P的相对原子质量为32 | |
| C. | ${\;}_{15}^{52}$P原子的质量数是17 | |
| D. | ${\;}_{15}^{52}$P原子中含有的电子数和质子数都是15 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) |
| 436kJ | akJ | 369kJ |
| A. | 200 | B. | 230 | C. | 260 | D. | 404 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
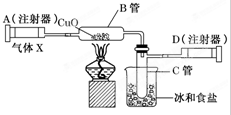 如图所示的实验装置可用来测定含两种元素的气体X的分子式.
如图所示的实验装置可用来测定含两种元素的气体X的分子式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
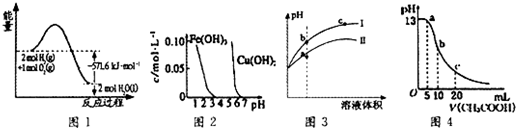
| A. | 图1表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. | 由图2得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. | 图3表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. | 图4表示常温下向体积为10 mL0.1 mol/LNaOH溶液中逐滴加入0.1 mol/LCH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
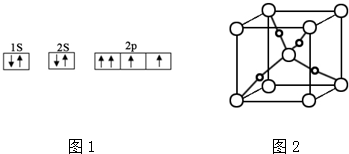
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 0.1mol•L-1的KHA溶液,其PH=10:c(K+)>c(OH-)>c(HA-)>c(H+) | |
| C. | 20mL0.1mol•L-1醋酸钠溶液与10mL 0.1mol•L-1盐酸混合后的溶液中: 2 c(H+)+c(CH3COOH)=c(CH3COO-)+2 c(OH-) | |
| D. | 在25mL 0.1 mol•L-1NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液,溶液pH变化如图所示,在A、B间任一点,溶液中一定都存在下列关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)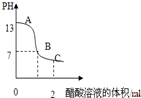 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com