
| ①CH3COOH | ②H2CO3 | ③H2S | ④H4PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |


科目:高中化学 来源: 题型:
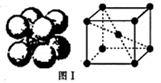 现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.
现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.| A是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离分别是:I1=738kJ?mol-1 I2=1451kJ?mol-1 I3=7733kJ?mol-1 I4=10540kJ?mol-1 |
| D原子核外所有p轨道全充满或半充满 |
| E元素基态原子的核外电子排布为1s22s22p63s23p5 |
| F元素基态原子是前四周期中未成对电子数最多的元素 |
| G在周期表的第8列 |
| H元素原子价电子排布式为3d104s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
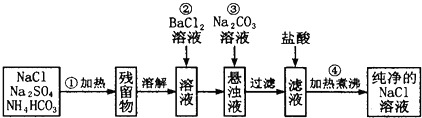
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金的熔点一般比组分金属低 |
| B、铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na) |
| C、铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D、若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
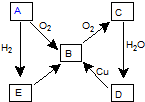 图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).
图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若反应中转移的电子为nmol,则0.15<n<0.25 |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、与NaOH反应的氯气一定为0.3mol |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
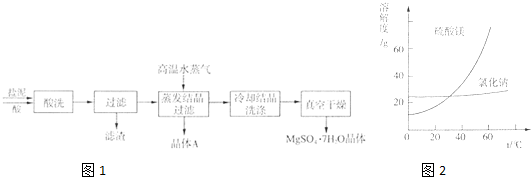
| ||
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
| B、100ml 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2═2Fe3++2Cl- | ||||
C、NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
| ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com