


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
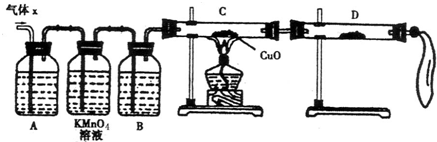
(8分)某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气
体,将该气体体积折算成标准状况为11.2L。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是__________,产生这种结果的主要原因是(用离子方程式表示)_________________ 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。
①A中加入的试剂可能是__________,B中加入的试剂可能是_________。
②观察到C中的实验现象是____________________,D中最好选择的试剂是________。
(3)理论分析:若该小组同学收集到气体的质量为25.8g,所用浓硫酸的物质的量浓度为18.0mol/L。则通过计算确定气体X中各成分物质的量分别为_____________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年海南省海口市高三高考调研测试地化学试卷 题型:实验题
(11分)某化学兴趣小组为了探究锌与硫酸反应的产物,选用了12mol/L的硫酸50ml与过量的锌在加热条件下反应,对硫酸的还原产物进行确定检验。
(1)提出假设。根据所学的知识,他们对硫酸的还原产物提出了三种假设:
假设1:_________________________________;
假设2:_________________________________;
假设3:有SO2与H2 两种气体。
(2)设计实验方案证明假设。小组为了证明假设3,选用了如图所示的仪器与药品,按气流由左至右的方向,仪器的接口顺序为a→
(仪器与药品可重复使用)。
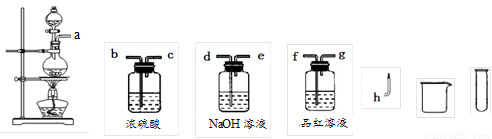
(3)实验过程。根据(2)中的实验方案进行实验。依据所给仪器和条件,要证明有H2产生,应采用的实验操作方法是___________________________________________。
(4)实验结论。通过上述实验,证明确有SO2与H2 两种气体产生。请你从理论上给予合理的解释:_______________________________________________________。
(5)反应停止后,将烧瓶中的液体过滤,滤液用水稀释,加入足量的BaCl2溶液,充分反应后过滤,得到81.55g沉淀。则在该实验中生成的SO2与H2的体积比为__________(同温同压)。
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江省高一上学期期末考试化学试卷 题型:实验题
(12分)某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L。
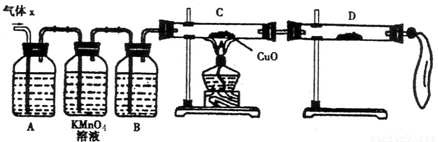
(1) 化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
(填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。
①A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 。
②证实气体X中混有杂质气体,D中应选择的试剂是 ,同时应观察到C中的实验现象是 。
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列 。
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为: 。
查看答案和解析>>
科目:高中化学 来源:09-10年黄冈中学高一下学期期末考试化学卷 题型:实验题
(8分)某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气
体,将该气体体积折算成标准状况为11.2L。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是__________,产生这种结果的主要原因是(用离子方程式表示)_________________ 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。
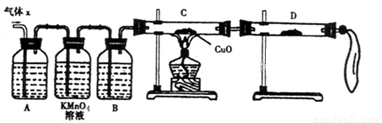
①A中加入的试剂可能是__________,B中加入的试剂可能是_________。
②观察到C中的实验现象是____________________,D中最好选择的试剂是________。
(3)理论分析:若该小组同学收集到气体的质量为25.8g,所用浓硫酸的物质的量浓度为18.0mol/L。则通过计算确定气体X中各成分物质的量分别为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com