
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在pH=1的溶液中:K+、Na+、SO42–、HCO
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO 、SO42–
、SO42–
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH 、I-、SCN-
、I-、SCN-
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO
科目:高中化学 来源: 题型:
 下列叙述正确的是
下列叙述正确的是
 A. 0.1 mol/L C6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
A. 0.1 mol/L C6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
 B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
 C. pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等
C. pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等
 D. 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D. 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g)=2C(g)+D(g), 在四种不同情况下的反应速率分别为
①v(A) =0.15mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.5mol/(L·s) ④v (D) =0.45mol/(L·s)
则反应进行由快到慢的顺序为
A.④>③>①>② B.②>④>③>① C.②>③>④>① D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃组成的混合气体0.1 mol,完全燃烧得0.15 mol CO2和3.6 g H2O,下列关于该混 合气体的说法正确的是( )
A.一定有乙烯 B.一定没有乙烯
C.一定有甲烷 D.可能有乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
实验题
“酒是陈的香”的原因之一是储存过程中生成了有香味的酯。
 实验室用下图所示装置制取乙酸乙酯。
实验室用下图所示装置制取乙酸乙酯。
①试管a中生成乙酸乙酯的化学反应方程式
是 。
②试管b中盛放的试剂是
溶液,试管b中的导管不伸入 液面下的原
因是 。
试管b中发生反应的化学方程式是 。
③生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+ 。下列叙述不正确的是
A.氧化产物为Cl2
B.氧化剂与还原剂的物质的量之比为1∶2
C.若有3mol H2O生成,则反应中有2mol电子转移
D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO、Fe2O3的混合物中加入120mL4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol B.0.21 mol C.0.16 mol D.0.14 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是
A.NH4H的电子式为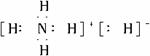
B.NH4Cl的电子式为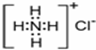
C.NH4H含有极性共价键和离子键
D.NH4H固体投入少量热水中,有两种气体生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com