
 2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是| A.在2min内,v (SO2)="0.25" mol·L-1·min-1 |
| B.若再充入0.1molSO3,达到平衡后SO3的质量分数会减小 |
| C.在1min时,c(SO2)+c(SO3)="0.01" mol·L-1 |
| D.若恒温恒压下,在10L的密闭容器中加入0.1molSO2和0.05molO2,平衡后反应放热小于0. 025a kJ |


科目:高中化学 来源:不详 题型:单选题
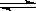 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( )
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( )| A.1.2mol/(L·min) | B.1mol/(L·min) |
| C.0.6mol/(L·min) | D.0.4mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 物质 | M | N | R |
| 初始浓度/mol?L—1 | 0.20 | 0.30 | 0 |
| 平衡浓度/mol?L—1 | 0.02 | 0.21 | 0.18 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3C(g) + 4D(g)中,表示该反应速率最快的是
3C(g) + 4D(g)中,表示该反应速率最快的是查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验 序号 | 碳酸钙 状态 | c(HCl) /mol·L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 =I3- +2SO42-的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42-的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/ mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c( )/mol·L-1 )/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4 | B.3 | C.2 | D.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )| A.vA=vB | B.vA=2vC | C.vB=3vD | D.3vB=vC |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,A的平均反应速率为
,A的平均反应速率为 ,则10秒钟后容器中含的B是( )
,则10秒钟后容器中含的B是( )| A.1.6mol | B. | C.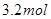 | D. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com