
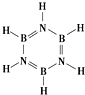
 元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.
元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| A、①② | B、①②③ |
| C、①②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、增加铁的量 |
| B、将容器体积缩小一半 |
| C、升高温度 |
| D、压强不变,充入N2使容器体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol H2燃烧放出的热量为H2的燃烧热 |
| B、饱和石灰水中加入少量CaO,恢复至室温后溶液的c(Ca2+)不变 |
| C、铅蓄电池放电过程中,正极质量增加,负极质量减小 |
| D、为除去FeCl3溶液中的CuCl2,可通入H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2O的分子数为1 NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有Cl-数为1 NA |
| C、64 g SO2中含有的氧原子数为1NA |
| D、常温常压下,14 g N2含有分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L |
| B、0.5mol/L |
| C、1.5mol/L |
| D、2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯离子的结构示意图 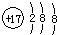 |
| B、HClO中Cl的化合价为:+1 |
| C、氯化钙的化学式:CaCl |
| D、硫酸的电离方程式:H2SO4=H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 制备并收集乙炔 |
B、 除去乙醇中溶有的少量乙酸 |
C、 制备少量乙酸乙酯 |
D、 石油的分馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com