
| A. | 冬天用煤炉取暖,为防止热量散失,应关紧门窗 | |
| B. | 进入古井前,应先做灯火试验 | |
| C. | 一次性塑料袋使用方便又经济,应大力提倡生产 | |
| D. | 油锅不慎着火,应立即用大量的水冲灭 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①⑥ | C. | ③④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 A+3 B→2 C | B. | A+3 B→2 C | C. | 3 A+B→2 C | D. | A+B→C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO3是还原剂 | |
| B. | 氧化性:ClO2>NaClO3 | |
| C. | 化学反应方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O | |
| D. | 1 mol NaClO3参加反应有2 mol e-转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
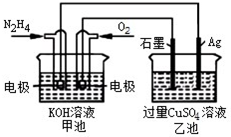
| A. | 甲池中,负极反应为N2H4-4e-═4H++N2 | |
| B. | 甲池溶液pH 保持不变,乙池溶液pH 减小 | |
| C. | 甲池中消耗2.24LO2,此时乙池中理论上多产生12.8g 固体 | |
| D. | 反应一段时间后,向乙池中加一定量CuO 固体,能使CuSO4溶液恢复到原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应达到化学平衡状态时,正、逆反应的速率都为0 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成油 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com