


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
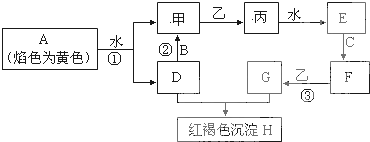
| 盐酸 |
| 蒸馏 |
| 一定条件 |
| 用标准溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
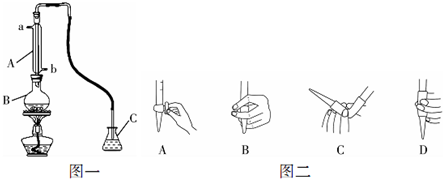
| A、用酒精萃取碘水中的碘 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、配制浓H2SO4和浓HNO3的混酸时,应将H2SO4慢慢加到浓HNO3中,并及时搅拌和冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:
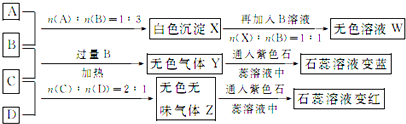
查看答案和解析>>
科目:高中化学 来源: 题型:
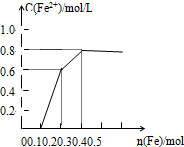 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方法a | 用炭粉在高温条件下还原CuO | ||||
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; | ||||
| 方法c | 电解法,反应为2Cu+H2O
| ||||
| 方法d | 用肼(N2H4)还原新制Cu(OH)2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于7或等于7 |
| B、小于7 |
| C、小于7或等于7 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com