
分析 (1)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(CuI)并析出碘,配平书写离子方程式;
(2)Cu2+能发生水解反应溶液呈酸性,加入硫酸可抑制水解;
(3)胆矾加酸溶解后溶液中含有Fe3+,Fe3+能氧化I-生成I2,Fe3+的存在影响Cu2+的测定;
(4)氧气能将碘离子氧化为碘单质,影响Cu2+的测定;
(5)碘单质遇到淀粉变蓝色,随硫代硫酸钠溶液滴入,碘单质反应完全后,溶液蓝色变为无色;
根据关系式:2Cu2+~I2~I3-~2S2O32-计算出Cu2+的质量,再用Cu2+的质量除以样品质量即可.
解答 解:(1)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,离子方程式为:2Cu2++4I-=2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2;
(2)Cu2+能发生水解反应溶液呈酸性,提供酸性条件,抑制Cu2+的水解,
故答案为:提供酸性条件,抑制Cu2+的水解;
(3)胆矾加酸溶解后溶液中含有Fe3+,Fe3+能氧化I-生成I2,造成Cu的质量偏大,影响测定结果,加入少量NaF,发生反应Fe3++6F-=[FeF6]3-,FeF63-不能氧化I-,
故答案为:掩蔽Fe3+,防止造成偏大的误差;
(4)用碘量瓶溶液不与空气中氧气接触,而用普通锥形瓶能与空气中氧气接触,氧气能与碘化钾反应生成单质碘,导致消耗Na2S2O3标准溶液偏小,测定Cu元素质量分数偏低,所以用碘量瓶防止空气中的氧气与碘化钾反应,影响I2的量的测定,
故答案为:加盖磨口塞可防止空气进入锥形瓶氧化I-,影响I2的量的测定;偏低;
(5)滴定实验是用Na2S2O3标准溶液滴定反应生成的碘单质,碘单质遇淀粉溶液变蓝色,选择滴定指示剂为淀粉,滴定终点判断为:当加入最后一滴Na2S2O3标准溶液时,锥形瓶中溶液恰好由蓝色转变为无色且半分钟不变化即到达滴定终点,
故答案为:淀粉溶液;当加入最后一滴Na2S2O3标准溶液时,锥形瓶中溶液恰好由蓝色转变为无色且半分钟不变化;
Na2S2O3标准溶液的物质的量为cmol/L×V×10-3L,由关系式:2Cu2+~I2~I3-~2S2O32-,可知Cu2+的物质的量为cmol/L×V×10-3L,Cu2+的质量为:cmol/L×V×10-3L×64g/mol,所以ω(Cu)=$\frac{cmol/L×V×1{0}^{-3}L×64g/mol}{ag}$×100%=$\frac{64cV}{10a}$%,
故答案为:$\frac{64cV}{10a}$%.
点评 本题考查物质的含量的测定,涉及氧化还原反应滴定应用,侧重于学生实验能力和分析能力的考查,注意利用关系式法解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO(g)+O2(g)═2NO2(g) | B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g) | ||
| C. | NH4NO3(s)═NH4+(aq)+NO3-(aq) | D. | H2(g)+Cl2(g)═2HCl(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
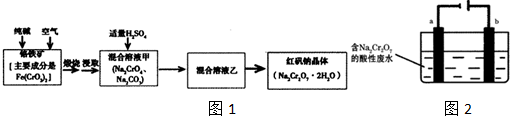
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯.BPA的结构简式如图所示.
双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯.BPA的结构简式如图所示.
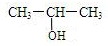 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2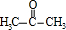 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,⑤的电子式是
,⑤的电子式是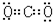 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com