
【题目】硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。 某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素分别转化为氢氧化物沉淀而分离开来。

已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:

(1)工业上用固体A作原料制取水玻璃的化学方程式为_________。
(2)固体E的化学式为_________。
(3)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_______。
(4)上述流程中的试剂Y最好选用下列中的_______(选填字母编号)。
A.水 B.硫酸 C.氨水 D.氢氧化钠
(5)写出反应F→H的离子方程式_________。
【答案】SiO2+2NaOH==Na2SiO3+H2O Mg(OH)2 250ml容量瓶 D AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-
【解析】
硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加入过量的盐酸时,二氧化硅和盐酸不反应,所以A是二氧化硅,Fe2O3、Al2O3、MgO和盐酸反应,所以溶液B的溶质为氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加入试剂X并调节溶液的pH值为3.5,结合题意溶液pH=3.5时Fe3+已经沉淀完全知,试剂X是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂X只能是强碱溶液,固体C是氢氧化铁,向溶液D中加入试剂X并调节溶液的pH值为13,溶液成强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子结合生成氢氧化镁沉淀,所以固体E为氢氧化镁,溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入二氧化碳气体,偏铝酸钠与二氧化碳反应沉淀氢氧化铝沉淀,所以G为氢氧化铝,据此答题。
(1)由分析可知:固体A为二氧化硅,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,故答案为:SiO2+2NaOH=Na2SiO3+H2O。
(2)由分析可知:固体E为Mg(OH)2,故答案为:Mg(OH)2。
(3)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要250mL容量瓶和胶头滴管;故答案为:250mL容量瓶。
(4)阳离子Mg2+以氢氧化物形式沉淀所需试剂,根据题给信息和流程可知应该先用氢氧化钠溶液将Mg2+转化成氢氧化镁沉淀析出同时将Al3+转化成AlO2-溶液;故答案为:D。
(5)F→H的反应是AlO2-与CO2反应,过量CO2反应的产物为碳酸氢盐,反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;故答案为:AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应:Na+2H2O═Na++2OH﹣+H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D. 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。在光照条件下,氯气和氢气反应过程如下:
![]()
(1)写出氯元素的原子结构示意图________反应②中形成的化合物的电子式为_________;反应③中被破 坏的化学键属于________键。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是________________。
(3)与氯元素同周期且金属性最强的元素在周期表中的位置为________________。
(4)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是________________。
a.卤化银的颜色按 AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按 H—F、H—C1、H—Br、H—I 的顺序依次减小
c.卤化氢的还原性按 HF、HCl、HBr、HI 的顺序依次增强
d.卤素单质与氢气化合按 F2、C12、Br2、I2 的顺序由难变易
(5)卤素单质的键能大小如图。由图推断:

①非金属性强的卤素,其单质分子的化学键_____ 断裂(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数( )
A. 只有x+1 B. 可能是x+8
C. 可能是x+2 D. 可能是x+1或x+11或x+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池,是一种高效无污染的清洁电池,它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池,下图是氢氧燃料电池。

(1)该电池的负极是通_____(填通入的气体)。
(2)如果是碱性燃料电池则负极反应方程式是:___________。
(3)如果是酸性燃料电池则正极极反应方程式是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硝石又名智利硝石,主要成分为NaNO3。据最新勘探预测表明,我国吐鲁番盆地钠硝石资源量约2.2亿吨,超过了原世界排名第一的智利。一种以钠硝石为原料制备KNO3的流程如下图所示(矿石中其他物质均忽略):
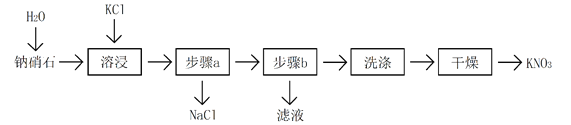
相关化合物溶解度随温度变化曲线如下图所示:
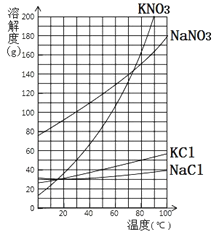
回答下列问题:
(1) NaNO3是________________(填“电解质”或“非电解质”)。
(2) 一定温度下,NaNO3可分解生成Na2O、NO和O2,该反应的化学方程式为__________________。
(3) 为提高钠硝石的溶浸速率,可对矿石进行何种预处理________________(答出一种即可)。
(4) 为减少KNO3的损失,步骤a的操作应为:________________________________;
步骤b中控制温度可为下列选项中的________。
A.10℃ B.40℃ C.60℃ D.90℃
(5) 如何验证洗涤后的KNO3中没有Cl-:_______________________________________。
(6) 若100吨钠硝石可生产60.6吨KNO3,则KNO3的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸与碱中和反应热化学方程式可用:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1来表示的是(Q1,Q2,Q3,Q4都大于0) ( )
A. CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
B. ![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
C. HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-Q3 kJ·mol-1
D. ![]() H3PO4(aq)+
H3PO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)= ![]() Ba3(PO4)2(s)+H2O(l) ΔH=-Q4 kJ·mol-1
Ba3(PO4)2(s)+H2O(l) ΔH=-Q4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com