
【题目】SO2和CO均为燃煤烟气中的主要污染物,对二者的治理备受瞩目。
请回答下列问题:
(1)下列事实中,不能用于比较硫元素和碳元素非金属性强弱的是___________(填选项字母)。
A.SO2能使酸性KMnO4溶液褪色而CO2不能
B.相同条件下,硫酸的酸性强于碳酸
C.CS2中硫元素显-2价
D.相同条件下,SO3的沸点高于CO2
(2)有人设计通过硫循环完成二者的综合处理,原理为
i.2CO(g) +SO2 (g)![]() S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
ii.S(l) + 2H2O(g)![]() 2H2(g) + SO2(g) △H2 =-45.4 kJ·mol-1
2H2(g) + SO2(g) △H2 =-45.4 kJ·mol-1
1 mol CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________。
(3)T℃,向5L恒容密闭容器中充入2 mol CO和1 mol SO2,发生反应i。10min达到平衡时,测得S(l)的物质的量为0.8mol。
①010 min内,用CO表示该反应速率v(CO)=____________________。
②反应的平衡常数为______________________。
(4)起始向密闭容器中充入一定量的S(1)和H2O(g),发生反应ii。H2O(g)的平衡转化率与温度(T)和压强(p)的关系如图所示。

①M、P两点的平衡转化率:a(M)___________a(P)(填“>”“<”或“=”),理由为_____________________。
②N、P两点的平衡常数:K(N)___________K(P)(填“>”“<”或“=”)。
【答案】 A D CO(g) + H2O(g)![]() CO2(g) + H2(g) △H=-41.2 kJ·mol-1 0.032 mol·L-1·min-1 400 > P点的温度和压强均高于M点,该反应为气体分子总数增大的放热反应,升高温度和增大压强均使平衡逆向移动,H2O(g)的平衡转化率减小 <
CO2(g) + H2(g) △H=-41.2 kJ·mol-1 0.032 mol·L-1·min-1 400 > P点的温度和压强均高于M点,该反应为气体分子总数增大的放热反应,升高温度和增大压强均使平衡逆向移动,H2O(g)的平衡转化率减小 <
【解析】试题分析:(1)根据最高价含氧酸酸性强弱、气态氢化物的稳定性、单质的氧化性比较非金属性的强弱;(2)根据盖斯定律计算1 mol CO和水蒸气完全反应生成H2和CO2的焓变;(3)①根据![]() 计算反应速率;②平衡常数为k=
计算反应速率;②平衡常数为k=![]() ;(4)①P点的温度和压强均高于M点,该反应为气体分子总数增大的放热反应,升高温度和增大压强均使平衡逆向移动,H2O(g)的平衡转化率减小;②反应放热,温度升高,平衡逆向移动,K减小,故小于。
;(4)①P点的温度和压强均高于M点,该反应为气体分子总数增大的放热反应,升高温度和增大压强均使平衡逆向移动,H2O(g)的平衡转化率减小;②反应放热,温度升高,平衡逆向移动,K减小,故小于。
解析:(1)最高价含氧酸酸性越强元素非金属性越强、单质的氧化性越强,元素非金属性的越强,故选AD;(2)根据盖斯定律①![]() +②
+②![]() 得CO(g) + H2O(g)
得CO(g) + H2O(g)![]() CO2(g) + H2(g) △H=-41.2 kJ·mol-1;
CO2(g) + H2(g) △H=-41.2 kJ·mol-1;
(3)①10min达到平衡时,测得S(l)的物质的量为0.8mol,
根据![]() ,
,![]() 0.032 mol·L-1·min-1 ;
0.032 mol·L-1·min-1 ;
②平衡常数为k=![]() =
=![]() 400 ;
400 ;
(4)①P点的温度和压强均高于M点,该反应为气体分子总数增大的放热反应,升高温度和增大压强均使平衡逆向移动,H2O(g)的平衡转化率减小,a(M)>a(P);②反应放热,温度升高,平衡逆向移动,K减小,K(N)<K(P)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质中符合Cm(H2O)n的组成,但不属于糖类的是( )
①纤维素 ②甲酸甲酯 ③淀粉 ④甲醛 ⑤丙酸 ⑥乳酸(α羟基丙酸) ⑦乙二醇 ⑧乙酸
A. ②③④⑥ B. ②④⑥⑧ C. ①③④⑦ D. ②④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质,不考虑引入的水蒸气),有关除杂试剂和分离方法的选择不正确的是( )
选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | CH3CH3(CH2=CH2) | 溴水 | 洗气 |
B | CH3CH2Br(Br2) | NaOH溶液 | 分液 |
C | 溴苯(苯) | 蒸馏 | |
D | 乙烯(乙醇蒸气) | 水 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,氨水的电离常数Kb(NH3·H2O) = 1.8×10-5。该温度下,用0.1 mol·L-1的氨水滴定10.00 mL 0.1 mol·L-1的HA溶液,溶液的pH与所加氨水的体积(V)的关系如图所示。下列说法正确的是( )

A. HA为弱酸
B. M点溶液中存在c(A-)=c(NH4+)+c(NH3·H2O)
C. M、N两点溶液中水电离出来的c(H+):M<N
D. 25℃时,NH4+的水解平衡常数为1.8×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容密闭容器中发生反应2NO2![]() 2NO+O2,不能说明反应达到平衡状态的是( )
2NO+O2,不能说明反应达到平衡状态的是( )
A. 2v(O2)=v(NO2) B. 单位时间内生成n mol O2的同时生成2n molNO2
C. 混合气体的颜色不再改变 D. 混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列变化的化学用语正确的是( )
A. 硫化钠溶于水显碱性: S2-+2H2O![]() H2S↑+2OH-
H2S↑+2OH-
B. 明矾净水原理:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D. Na2HPO4在水中的电离:Na2HPO4![]() 2Na++ HPO42-
2Na++ HPO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是重要的氨化剂,在潮湿的空气中能转化为碳酸铵,受热易分解、易被氧化。实验小组对氨基甲酸铵的性质进行了如下探究。请回答下列问题:
(1)氨基甲酸铵在潮湿的空气中转化为碳酸铵的化学方程式为____________________________。
(2)用下图装置探究氨基甲酸铵的分解产物(夹持装置略去,下同)。

①点燃A处的酒精灯之前,需先打开k,向装置中通入一段时间的N2,目的为_________________。
②仪器B的名称为_________________。
③装置D的作用为________________________________________________________。
④能证明分解产物中有NH3的现象为_________________________________________。
⑤试剂A用于检验分解产物中的CO2,该试剂的名称为_______________________。
(3)已知:CuO高温能分解为Cu2O和O2。若用上述装置和下列部分装置进一步检验分解产物中是否有CO,装置E后应依次连接_________________(按从左到右的连接顺序填选项字母)。
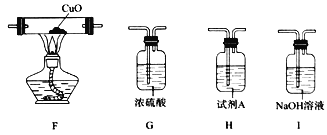
(4)通过实验得出结论:氨基甲酸铵受热分解为NH3和CO2。该反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是
A. 1 mol SO2的质量是64 g/mol
B. 常温常压下,1 mol SO2的体积为22.4 L
C. SO2的摩尔质量是64 g
D. 1mol SO2中所含分子数约为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com