
分析 有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液,说明不含有色离子和难溶性物质,则一定不含CaCO3、CuSO4;
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,说明白色沉淀应该是硫酸钡而不是碳酸钡,则溶液中不含Na2CO3,含有Na2SO4;
在另一份中加入NaOH溶液,也产生白色沉淀,白色沉淀是氢氧化镁,则溶液中含有MgCl2,
其余物质不能确定是否含有;
据此分析解答.
解答 解:有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液,说明不含有色离子和难溶性物质,则一定不含CaCO3、CuSO4;
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,说明白色沉淀应该是硫酸钡而不是碳酸钡,则溶液中不含Na2CO3,含有Na2SO4;
在另一份中加入NaOH溶液,也产生白色沉淀,白色沉淀是氢氧化镁,则溶液中含有MgCl2,
其余物质不能确定是否含有;
(1)通过以上分析知,一定不含的物质是CuSO4、CaCO3、Na2CO3,故答案为:CuSO4、CaCO3、Na2CO3;
(2)通过以上分析知,原物质中一定含有的物质为Na2SO4、MgCl2,故答案为:Na2SO4、MgCl2;
(3)通过以上分析知,不能确定是否含有的物质为NaCl、KCl、KNO3,故答案为:NaCl、KCl、KNO3;
(4)②中所涉及到的其中一个反应的化学方程式为氯化钡和硫酸钠的反应或氯化镁和氢氧化钠的反应,反应方程式为BaCl2+Na2SO4=2NaCl+BaSO4↓或MgCl2+2NaOH=2NaCl+Mg(OH)2↓,故答案为:BaCl2+Na2SO4=2NaCl+BaSO4↓或MgCl2+2NaOH=2NaCl+Mg(OH)2↓.
点评 本题考查物质检验,为高频考点,明确物质性质及物质之间反应是解本题关键,知道常见物质的溶解性及其溶液颜色、物质之间的反应等知识点,题目难度不大.


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| 氧化物 | 酸 | 碱 | 盐 | |
| A | CuO | HCl | NH3•H2O | Na2SO4 |
| B | CO2 | CH3COOH | 火碱 | Cu(OH)2 |
| C | H2O | HBr | 纯碱 | BaSO3 |
| D | MnO2 | HClO | 生石灰 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 6种 | C. | 7种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液中水的电离程度相同 | B. | 水的离子积常数为1.0×10-(a+b) | ||
| C. | CH3COOH的电离常数为$\frac{(1{0}^{-2a})}{c}$ | D. | 两溶液中c(CH3COO-)=c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体中无FeCl2 | B. | ③中使KMnO4褪色的是NO2- | ||
| C. | G的pH>7 | D. | 固体由Ba(OH)2?AlCl3?Na2SO3组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
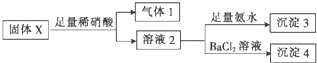
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
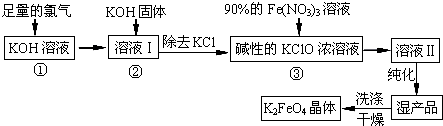
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com