
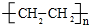 £®
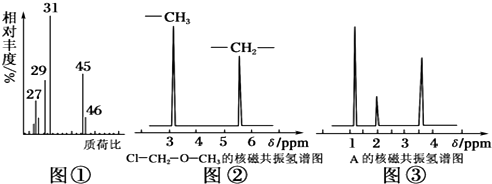
£® ·ÖĪö £Ø1£©ÅØĮņĖįŌöÖŲ5.4gĪŖÉś³ÉĖ®µÄÖŹĮ棬ĪļÖŹµÄĮæĪŖ0.3mol£¬¼īŹÆ»ŅŌöÖŲ8.8gæĖĪŖÉś³É¶žŃõ»ÆĢ¼µÄÖŹĮ棬ĪļÖŹµÄĮæĪŖ0.2mol£¬øł¾ŻŃõŌ×ÓŹŲŗćæÉÖŖÓŠ»śĪļÖŠŗ¬n£ØO£©=0.2mol”Į2+0.3mol-0.6mol=0.1mol£¬¼ĘĖć³öøĆĪļÖŹÖŠø÷ŌŖĖŲµÄŌ×ÓøöŹż±ČŹĒN£ØC£©£ŗN£ØH£©£ŗN£ØO£©£»
£Ø2£©ÖŹĘ×ŅĒ²ā¶ØÓŠ»ś»ÆŗĻĪļµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ46£¬½įŗĻ×ī¼ņŹ½ÅŠ¶Ļ·Ö×ÓŹ½ĪŖC2H6O£»
£Ø3£©ÓŠ»śĪļA·Ö×ÓÖŠÓŠČżÖÖ²»Ķ¬»Æѧ»·¾³µÄĒāŌ×Ó£¬Ó¦ĪŖŅŅ“¼£¬¶ž¼×ĆŃÖ»ÓŠŅ»ÖÖ²»Ķ¬»Æѧ»·¾³µÄĒāŌ×Ó£»
£Ø4£©AŌŚŅ»¶ØĢõ¼žĻĀĶŃĖ®æÉÉś³ÉB£¬BĪŖCH2=CH2£¬BæÉŗĻ³É°ü×°ĖÜĮĻC£¬CĪŖ¾ŪŅŅĻ©£®
½ā“š ½ā£ŗ£Ø1£©n£ØCO2£©=$\frac{8.8g}{44g/mol}$=0.2mol£¬n£ØH2O£©=$\frac{5.4g}{18g/mol}$=0.3mol£¬n£ØO2£©=$\frac{6.72L}{22.4L/mol}$=0.3mol£¬ŌņÓŠ»śĪļÖŠŗ¬n£ØO£©=0.2mol”Į2+0.3mol-0.6mol=0.1mol£¬ŌņÓŠ»śĪļÖŠN£ØC£©£ŗN£ØH£©£ŗN£ØO£©=0.2mol£ŗ0.6mol£ŗ0.1mol=2£ŗ6£ŗ1£¬
¹Ź“š°øĪŖ£ŗ2£ŗ6£ŗ1£»
£Ø2£©×ī¼ņŹ½ĪŖC2H6O£¬ÓŠ»ś»ÆŗĻĪļµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ46£¬ŌņøĆĪļÖŹµÄ·Ö×ÓŹ½ŹĒC2H6O£¬
¹Ź“š°øĪŖ£ŗC2H6O£»
£Ø3£©ÓŠ»śĪļA·Ö×ÓÖŠÓŠČżÖÖ²»Ķ¬»Æѧ»·¾³µÄĒāŌ×Ó£¬Ó¦ĪŖŅŅ“¼£¬¼“CH3CH2OH£¬¶ž¼×ĆŃÖ»ÓŠŅ»ÖÖ²»Ķ¬»Æѧ»·¾³µÄĒāŌ×Ó£¬
¹Ź“š°øĪŖ£ŗCH3CH2OH£»
£Ø4£©AŌŚŅ»¶ØĢõ¼žĻĀĶŃĖ®æÉÉś³ÉB£¬BĪŖCH2=CH2£¬BæÉŗĻ³É°ü×°ĖÜĮĻC£¬CĪŖ¾ŪŅŅĻ©£¬B×Ŗ»ÆĪŖCµÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ£ŗnCH2=CH2$\stackrel{“߻ƼĮ}{”ś}$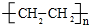 £¬
£¬
¹Ź“š°øĪŖ£ŗnCH2=CH2$\stackrel{“߻ƼĮ}{”ś}$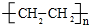 £®
£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļ½į¹¹Ź½µÄČ·¶Ø£¬ÕĘĪÕČ¼ÉÕ·ØĄūÓĆŌ×ÓŹŲŗćĒ°ŗóÓŠ»śĪļ·Ö×Ó£¬¶ŌÖŹĘ×Ķ¼”¢ŗĖ“Ź²ÕńĒāĘ×”¢ŗģĶā¹āĘ×Ķ¼½ųŠŠ¼ņµ„Ź¶¶Į£¬ĢāÄæÄŃ¶Č²»“ó£®


 ѧ¶ųÓÅŹīĘŚĻĪ½ÓÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
ѧ¶ųÓÅŹīĘŚĻĪ½ÓÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø Happy holiday»¶ĄÖ¼ŁĘŚŹī¼Ł×÷Ņµ¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
Happy holiday»¶ĄÖ¼ŁĘŚŹī¼Ł×÷Ņµ¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc£ØOH-£©=10a-14 | |
| B£® | ¼ÓĖ®Ļ”ŹĶ£¬$\frac{c£ØC{H}_{3}COOH£©}{c£ØC{H}_{3}CO{O}^{-}£©•c£Ø{H}^{+}£©}$¼õŠ” | |
| C£® | øĆĪĀ¶ČĻĀ£¬pH=aµÄNaOHČÜŅŗµÄĪļÖŹµÄĮæÅØ¶ČŠ”ÓŚ0.1mol•L-1 | |
| D£® | ¼ÓČėµČÅØ¶Č”¢µČĢå»żµÄCH3COOHČÜŅŗ£¬ĖłµĆČÜŅŗÖŠc£ØCH3COO-£©+c£ØCH3COOH£©=2c£ØNa+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņĢ¼ĖįĒāøĘČÜŅŗÖŠ¼ÓČėÉŁĮæÉÕ¼īČÜŅŗ£ŗCa2++2HCO3-+20H-ØTCaCO3”ż+CO32-+H2O | |
| B£® | µāĖ®ÖŠĶØČė×ćĮæµÄ S02£ŗI2+SO2+2H2OØT2I-+S042-+4H+ | |
| C£® | ĻņĀČ»ÆĀĮČÜŅŗÖŠµĪ¼Ó¹żĮæ°±Ė®£ŗAl3++4NH3•H2OØTA1O2-+4NH4++2H2O | |
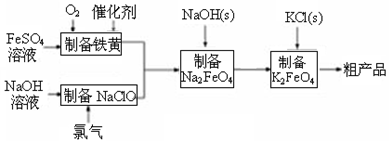
| D£® | ŌŚĒæ¼īČÜŅŗÖŠ“ĪĀČĖįÄĘÓėFe£Ø0H£©3·“Ӧɜ³ÉNa2FeO4£ŗ3ClO+2Fe£ØOH£©3ØT2FeO32-+3Cl-+H2O+4H+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com