
| A. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
分析 A.乙醇与水互溶,不能用乙醇作萃取剂萃取溴水中的溴;
B.钡离子有毒,冲入下水道会污染地下水;
C.将蒸发皿中NaCl溶液全部加热蒸干,会导致固体飞溅,发生危险;
D.容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体.
解答 解:A.乙醇和水是互溶的,不能用乙醇作为提纯溴水中溴单质的萃取剂,故A错误;
B.钡离子有毒,则Ba(NO3)2 的废液不能用水冲入下水道,防止污染地下水,故B错误;
C.蒸发时利用余热加热,则将蒸发皿中NaCl 溶液蒸发到大量晶体出现时停止加热,故C错误;
D.容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,浓硫酸溶于水放热,溶液的温度较高,应冷却后在转移到容量瓶中,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作和实验安全等,注重实验基本技能的考查,注意选项B中钡离子有毒,题目难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在5min内该反应用C的浓度变化表示的反应速率为0.2mol/(L•min) | |
| B. | 5min时,容器内D的浓度为0.2mol/L | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5min时容器内气体总的物质的量为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<0 | B. | △H2>0 | C. | △H1=△H3-2△H2 | D. | 2△H4>△H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
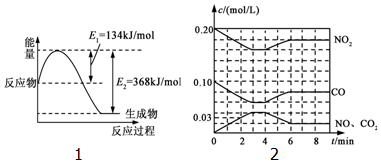 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在烷烃分子中,可能会有碳碳双键 | |
| B. | 烷烃中除甲烷外,很多都能使紫色KMnO4溶液褪色 | |
| C. | 分子通式为CnH2n+2的烃不一定是烷烃 | |
| D. | 所有的烷烃在光照条件下都能与氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol/L的MgCl 2溶液中,共含有Cl - 个数为 N A | |
| B. | 1mol任何气体的体积都为 22.4L | |
| C. | 7.8gNa 2O 2中所含阴离子的数目是0.1N A | |
| D. | 标准状况下,2.24L水中含有的分子数为0.1N A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
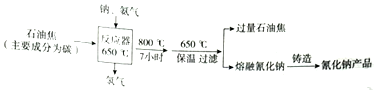

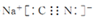 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com