
| A. | Na2CO3 | B. | NH4Cl | C. | CH3COONa | D. | H2SO4 |
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:选择题
 合成氨工业对国民经济和社会发展具有重要的意义.对于一定体积密闭容器中的反应:N2(g)+3H2(g)?NH3(g)(正反应为放热反应),673K、30MP下,n (NH3)和n (H2)随时间t变化的关系如图所示.下列叙述中,不正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于一定体积密闭容器中的反应:N2(g)+3H2(g)?NH3(g)(正反应为放热反应),673K、30MP下,n (NH3)和n (H2)随时间t变化的关系如图所示.下列叙述中,不正确的是( )| A. | 点c处正反应速率比逆反应速率大 | |
| B. | 点a的正反应速率比点b的正反应速率大 | |
| C. | 气体的平均摩尔质量:点b大于点a | |
| D. | 混合气体的密度:点b大于点a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32.0g | B. | 16.0 | C. | 18.0 | D. | 36.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1mol•L-1醋酸溶液稀释1000倍,测得pH约为5 | |
| B. | 用同浓度的NaOH溶液中和相同体积、相同pH的盐酸和醋酸溶液,比较消耗碱液体积的大小 | |
| C. | 醋酸钠溶液中加入酚酞试液后变红 | |
| D. | 0.01mol•L-1的CH3COOH溶液导电性实验中灯泡较暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向鸡蛋清的溶液中加入浓的硫酸铵溶液,蛋白质的性质发生改变并凝聚 | |
| B. | 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,下层析出肥皂 | |
| C. | 油脂为髙分子化合物,分子结构中都含有酯基 | |
| D. | 纤维素、麦芽糖在一定条件下均可转化为葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和液氯是两种不同的物质 | |
| B. | NH3是电解质,所以氨水能导电 | |
| C. | 氨不能用浓硫酸干燥,但可以用无水CaCl2干燥 | |
| D. | 新制的氯水呈酸性,向其中滴加几滴紫色石蕊试液并振荡,溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
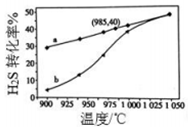 废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.
废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置能将化学能转化成电能 | B. | 铜片周围溶液变为蓝色 | ||
| C. | 电子由锌片通过外电路流向铜片 | D. | 溶液中SO42-向负极方向流动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com