
| Q | R | ||
| T | W |
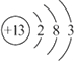 .
.分析 T所处的周期序数与族序数相等,应为第三周期第ⅢA族元素Al;然后根据元素所在周期表中的位置可知Q为C、R为N、W为S元素,根据原子的结构特点结合元素周期律的递变规律以及对应单质、化合物的性质解答该题.
解答 解:T所处的周期序数与族序数相等,应为第三周期第ⅢA族元素Al,再根据元素所在周期表中的位置可知Q为C、R为N、W为S元素,
(1)T为Al,为周期表13号元素,原子核外有3个电子层,最外层电子数为3,原子结构示意图为: ,
,
故答案为: ;
;
(2)根据S、C最高价氧化物对应的酸性硫酸强于碳酸,则可得非金属性S强于C,
故答案为:<;
(3)S与浓H2SO4发生反应,从元素守恒看,肯定有水生成,从化合价和性质分析,另外为一气体只能是SO2,则反应的化学方程式为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O,
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
点评 本题考查元位置、结构与性质的关系,题目难度中等,根据元素在周期表中相对位置推断出各元素为解答关键,注意掌握元素周期表结构、元素周期律内容.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
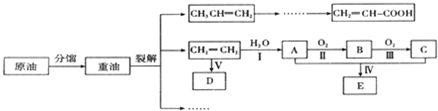
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | H+ | Na+ | NH4+ | NO3- | SO42- |
| 浓度(mol/L) | 1×10-5 | 2×10-5 | 3×10-5 | 4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能发生加成反应 | |
| B. | 乙醇和乙酸都能与氢氧化钠溶液反应 | |
| C. | 乙烯和苯都能使酸性KMnO4溶液褪色 | |
| D. | 葡萄糖和蔗糖都可发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
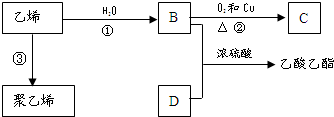 已知乙烯能发生如图转化
已知乙烯能发生如图转化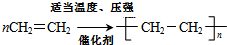 ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
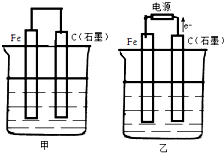 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 | B. | 最外层电子数 | C. | 电子层数 | D. | 次外层电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com