
| A. | 1mol H2O所含电子数为10NA | |
| B. | 1mol Al与足量的稀盐酸溶液反应生成氢气1.5mol | |
| C. | 在标准状况下,0.5NA Cl2所占的体积约是11.2L | |
| D. | 在非标准状况下,22.4L O2含有的分子数一定不是NA |
分析 A、水为10电子微粒;
B、根据得失电子数守恒来分析;
C、根据体积V=$\frac{N}{{N}_{A}}Vm$来计算;
D、在非标况下,气体摩尔体积也可能为22.4L/mol.
解答 解:A、水为10电子微粒,故1mol水中含10mol电子即10NA个,故A正确;
B、铝反应后变为+3价,故1mol铝失去3mol电子,能将3mol氢离子还原为1.5mol氢气,故B正确;
C、氯气在标况下的体积V=$\frac{N}{{N}_{A}}Vm$=$\frac{0.5{N}_{A}}{{N}_{A}}×22.4L/mol$=11.2L,故C正确;
D、在非标况下,气体摩尔体积也可能为22.4L/mol,即在非标况下,22.4L氧气的物质的量也可能为1mol,则分子数也可能为NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算和气体摩尔体积的数值,应注意的是在非标况下,气体摩尔体积也可能为22.4L/mol,D为易错点.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在溶液中加入少量新制氯水,再滴几滴KSCN溶液 | 溶液变红 | 原溶液中一定含有Fe2- |
| B | 将表面打磨过的铝丝置于浓硝酸中 | 无现象 | 铝与浓硝酸不反应 |
| C | 将鲜艳的红玫瑰置于盛有氯气的集气瓶中 | 玫瑰花褪色 | 氯气有漂白性 |
| D | 用洁净的进行铁丝蘸取某溶液进行焰色反应实验,并透过蓝色钴玻璃片观察 | 火焰呈紫色 | 原溶液中有K-,无法确定是否有Na+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
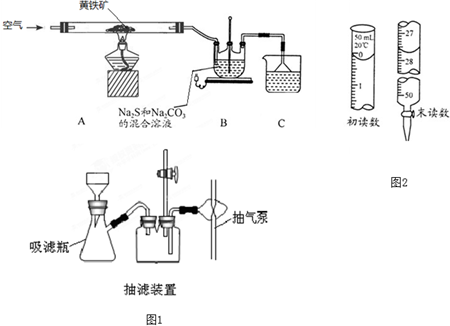

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
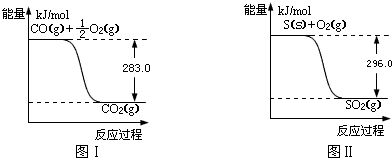

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com